
UNIVERSIDADE FEDERAL DE SÃO CARLOS
Campus
Sorocaba
Prática VII - Testes para Identificação de Funções Orgânicas
Docente: Profº Dr. Aparecido Júnior de Menezes
Discentes: Ana Paula Rodrigues Furtado RA.: 570974
Franciny Oliveira Rodrigues R.A.: 641286
Patrícia de Almeida R.A.: 427594
Sorocaba,
06 de maio de 2017.

1. Objetivos
Identificar compostos orgânicos através de testes específicos que distinguem
os grupos funcionais existentes nos compostos.
2. Introdução Teórica
Como base dos compostos orgânicos temos os hidrocarbonetos, que são
moléculas formadas por apenas carbono e hidrogênio, e isso lhes conferem
propriedades específicas. Mas há também, várias outras possibilidades de ligações
de diferentes átomos com a cadeia de carbono, de diferentes formas, gerando os
grupos funcionais. Um grupo funcional é definido como uma estrutura molecular que
confere às substâncias comportamentos químicos semelhantes. Ou seja, a
presença de uma dessas diferentes estruturas citadas, com combinações diferentes
e outros átomos além do hidrogênio e do carbono, confere à molécula propriedades
bem específicas, e esta irá interagir de maneira bem particular em determinadas
situações.
Ao conjunto de compostos que apresentam o mesmo grupo funcional dá-se o
nome de função orgânica. Para identificar a presença de uma função orgânica numa
determinada amostra, foram desenvolvidos testes com reagentes que interagem
com eles provocando alteração que pode ser percebida visualmente na mistura (no
caso de presença do grupo funcional específico que provoca aquela reação),
gerando precipitado, mudança na coloração, turbidez, liberação de gás, etc.
2.1. Aldeídos e Cetonas
Aldeídos e cetonas possuem semelhante característica estrutural: a presença
de um grupo carbonila (C=O) em suas fórmulas estruturais. A diferença está no fato
de as cetonas apresentam dois grupos alquil ou aril ligados à carbonila; já nos
aldeídos pelo menos um desses grupos é um hidrogênio.

Figura 1: Representação da fórmula estrutural de um aldeído e de uma cetona,
respectivamente.
Fonte: RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron
Books, 1994.
Quando comparados em relação a reatividade, os aldeídos diferenciam-se
das cetonas pela facilidade com que são oxidados a ácidos carboxílicos.
De um modo geral, esses compostos carbonílicos são muito reativos, e isso
se deve, principalmente, ao caráter eletrofílico do grupo carbonila e à acidez dos
hidrogênios ligados ao carbono alfa.
3. Materiais utilizados
● Trióxido de Cromo (CrO3)
● Água Destilada
● Ácido Sulfúrico (H2SO4)
●Ácido Clorídrico
● Cloreto de Zinco
● Bicarbonato de Sódio
● Balão Volumétrico
● Béqueres de Vários tamanhos
● Acetona
4. Metodologia
4.1 Reagentes
Iniciou-se o presente experimento preparando-se todos os reagentes e
soluções utilizados:
4.1.a Jones
Utilizando um béquer, dissolveu-se aproximadamente 20g de trióxido de
cromo em aproximadamente 60mL de água destilada, agitando-a magnéticamente.
Após, adicionou-se 20mL de ácido sulfúrico formando o ácido crômico.

4.1.b Lucas
Em um béquer, resfriou-se aproximadamente 10mL de ácido clorídrico.
Posteriormente, em constante agitação magnética, dissolveu-se aproximadamente
16g de cloreto de zinco.
4.1.c Bicarbonato de sódio (Ácido Craboxílico)
Em um béquer pesou-se aproximadamente 2,5g de Bicarbonato de Sódio.
Posteriormente, adicionou-se 30mL de água destilada e mexeu a solução até que o
Bicarbonato se dissolve-se completamente. Em seguida transferiu-se a solução para
um balão volumétrico de 50mL e completou o balão com água destilada até que se
atingisse o menisco.
4.2 Procedimento Experimental
Para os testes foram preparadas 2 amostras de diferentes substâncias
identificadas como A e B.
4.2.a Teste de Jones
Utilizando dois tubos de ensaio identificados como A e B, pipetou-se 1 gota
da amostra A no tubo A e uma gota da amostra B no tubo B adicionando-se á
ambos aproximadamente 1mL de acetona pura e 6 gotas de ácido crômico. .
4.2.b Teste de Lucas
Em um tubo de ensaio foram adicionadas 5 gotas da amostra que não reagiu
ao teste de Jones, seguido de aproximadamente 4mL do reagente de Lucas.
4.2.c Teste do Fenol
Em um tubo de ensaio adicinou-se uma pequena porção da amostra seguido
de 1mL de água e 8 gotas de cloreto de Ferro e agitou-se.
4.2.d Teste da Amina
Em um tubo de ensaio adicionou-se 2 gotas de amostra a ser analisada e 3
gotas de ácido sulfúrico.
4.2.e Teste do Ácido Carboxílico
Em um tubo de ensaio adicionou-se uma pequena quantidade de ácido
benzóico e aproximadamente 1mL de bicarbonato de sódio 5%.
5. Resultados e Discussões
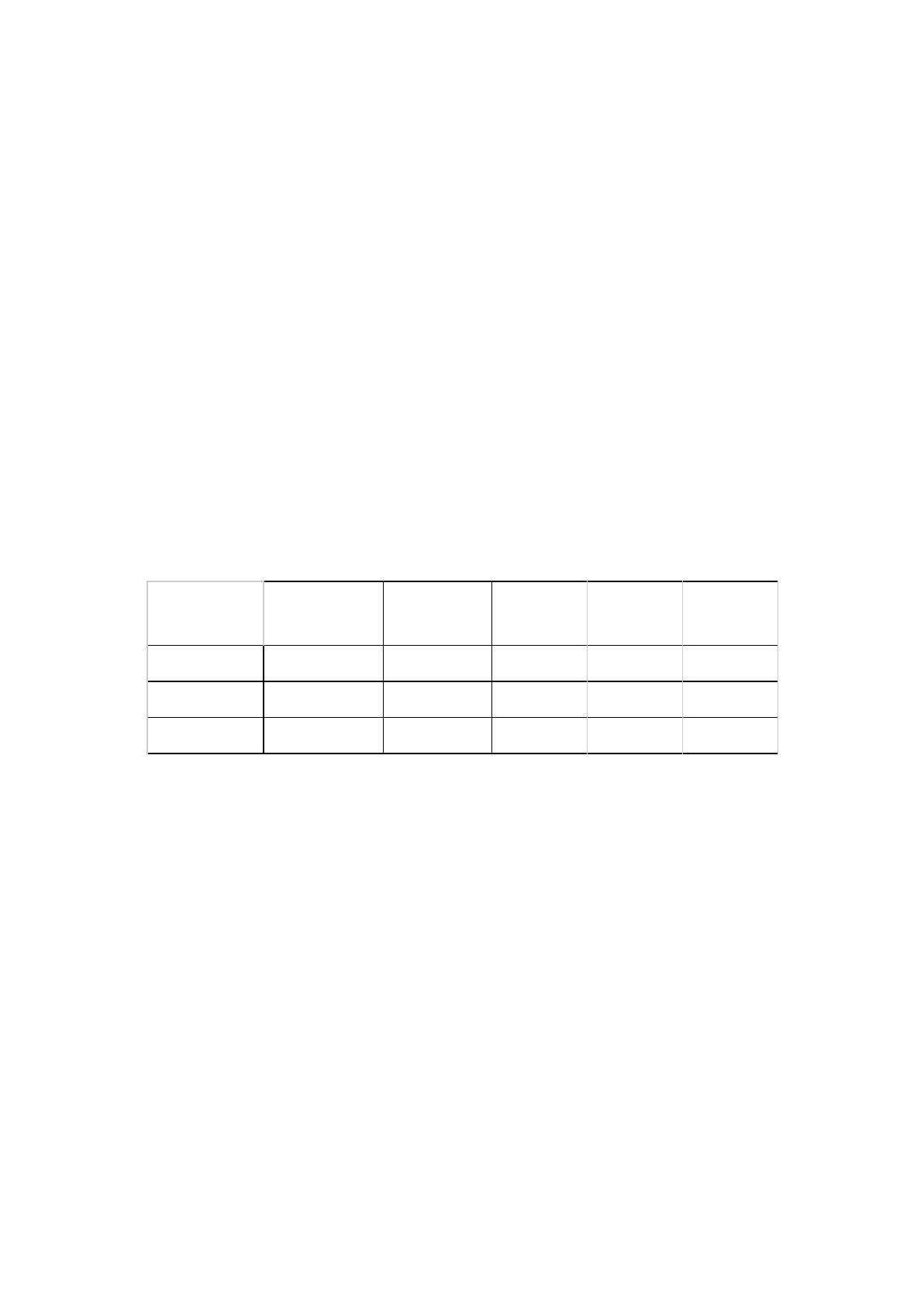
A Tabela 1 demonstra, de maneira geral, os resultados obtidos em cada um dos
testes com as diferentes amostras disponíveis.
Tabela 1: Resultado geral dos testes para cada uma das amostras verificadas.
Jones
Lucas
Fenol
Amina
Ácido
Carboxílico
Amostra A
Amostra B
Amostra C
5.a Teste de Jones
O teste de Jones se baseia na oxidação de álcoois primários e secundários,
utilizando o ácido crómico, ácidos carboxílicos e cetonas, enquanto álcoois terciários
não reagem. Assim que a oxidação ocorre é notada a formação de precipitado verde
devido ao sulfato crômico.
O teste de Jones também se torna útil na presença de aldeídos e fenóis,
resultando em positivo.
A amostra “C”, apresentou uma coloração esverdeada, comprovando que se
trata de um álcool primário ou secundário. As demais amostras não apresentaram
mudanças.

5.b Teste de Lucas
O presente teste consiste na formação de cloretos de alquilo dada através da
reação de álcoois com uma solução de cloreto de zinco em ácido clorídrico
concentrado.
Sob condições extremamente ácidas, os álcoois geram carbocations
intermediários que reagem com o íon cloreto. A função do cloreto de zinco é agir
como um catalisador, garantindo maior velocidade da reação na substituição em
alcoóis orgânicos.
Tal teste é utilizado para a identificação de álcool primário, secundário e
terciário, levando em conta a velocidade em que ocorre a reação.
A identificação ocorre pois os alcoóis com menos de seis carbonos se
apresentam solúveis, enquanto os haletos correspondentes não.
A formação do cloreto a partir do álcool é indicada por uma turvação imediata
da mistura em casos onde há a presença de álcool terciário, enquanto a turvação
leva cerca de cinco minutos para ocorrer na presença de alcoóis secundários. Na
presença dos alcoóis primários a turvação praticamente não aparece.
Como em primeiro momento não ocorreu nenhuma reação aparente, os tubos
de ensaio foram levados para aquecimento em banho-maria. Após o aquecimento, a
amostra “C” apresentou uma turvação, logo o álcool em questão é secundário.
5.c Teste do Fenol
Uma das características dos fenóis é a formação de complexos coloridos com
íon Fe3+, variando entre uma coloração do azul ao vermelho.
5.e Teste do Ácido Carboxílico
A solubilização da amostra na presença de bicarbonato de sódio, se
provocada a liberação de CO2, indica a presença de componentes ácidos.

6. Conclusão
A partir dos testes realizados com as três substâncias desconhecidas, foi
possível verificar que em cada teste identificou-se um composto orgânico e um
grupo funcional.
O teste com 2,4 dinitrofenilhidrazina, utilizado para distinguir e identificar
aldeídos e cetonas, nos mostrou com a presença de um precipitado amarelo, que a
amostra C não se trata de um aldeído ou cetona, podendo ser um fenol, álcool,
alceno ou éter.
O teste de Tollens, realizado com as amostras A e B, a partir da formação de
um espelho de prata, nos indicaram que a amostra B se tratava de um aldeído,
enquanto o último teste, Iodofórmio, nos explicitou a amostra A como uma cetona
metílica.
Assim, podemos concluir que as funções orgânicas se tornaram claras e
evidenciadas através da combinação de regentes que resultaram em precipitados,
colorações diferentes, liberação de gases entre outros, para o aperfeiçoamento e
melhor compreensão das semelhantes relações químicas e comportamentais que
esses compostos possuem em decorrência de seu grupo funcional.
7. Referências Bibliográficas
● Allinger, N. L.; Cava, M. C.; de Jongh, D. C.; Johnson, C. R.; Lebel, N. A. e
Stevens, C. L.; Química Orgânica, Editora Guanabara Dois S. A., segunda
edição, Rio de Janeiro – RJ, 1976.
● Apostila do curso de Química Orgânica pertencente á FACULDADE DE
CIÊNCIAS AGRÁRIAS E VETERINÁRIAS, FCAV – UNESP Jaboticabal, disponível
em

<http://javali.fcav.unesp.br/sgcd/Home/departamentos/tecnologia/LUCIANAM
ARIASARAN/aula-02-de-laboratorio.pdf>
Também referenciado como: goo.gl/Qjaqs1 acesso em 16/05/2017.
● BARBOSA, L. C. A.; ALMEIDA, P. G. V Introdução a química orgânica. 2. ed.
São Paulo: Pearson Prentice Hall, 2004. 311 p. ISBN 8576050064.
● Identificação de Compostos Orgânicos, disponível em <goo.gl/b6nmrq>
acesso em 16/05/2017.
● LOBO, Fabiana, Uso do reagente 2,4 dinitrofenilhidrazina como derivatizante
na determinação de formaldeído por CG-MS, disponível em
<http://www.sbq.org.br/37ra/cdrom/resumos/T0192-1.pdf>, acesso em 29 de
março de 2015.
● Síntese Orgânica do Iodofórmio, disponível em
<http://www.infoescola.com/quimica/sintese-organica-do-iodoformio/>, acesso
em 29 de março de 2015.
● SOLOMONS, T. W.; FRYHLE, C. B. Química orgânica. 8. ed. Rio de Janeiro.
Livros Técnicos e Científicos, 2005. 2v
Prévia do material em texto
UNIVERSIDADE FEDERAL DE SÃO CARLOS Campus Sorocaba Prática VII - Testes para Identificação de Funções Orgânicas Docente: Profº Dr. Aparecido Júnior de Menezes Discentes: Ana Paula Rodrigues Furtado RA.: 570974 Franciny Oliveira Rodrigues R.A.: 641286 Patrícia de Almeida R.A.: 427594 Sorocaba, 06 de maio de 2017. 1. Objetivos Identificar compostos orgânicos através de testes específicos que distinguem os grupos funcionais existentes nos compostos. 2. Introdução Teórica Como base dos compostos orgânicos temos os hidrocarbonetos, que são moléculas formadas por apenas carbono e hidrogênio, e isso lhes conferem propriedades específicas. Mas há também, várias outras possibilidades de ligações de diferentes átomos com a cadeia de carbono, de diferentes formas, gerando os grupos funcionais. Um grupo funcional é definido como uma estrutura molecular que confere às substâncias comportamentos químicos semelhantes. Ou seja, a presença de uma dessas diferentes estruturas citadas, com combinações diferentes e outros átomos além do hidrogênio e do carbono, confere à molécula propriedades bem específicas, e esta irá interagir de maneira bem particular em determinadas situações. Ao conjunto de compostos que apresentam o mesmo grupo funcional dá-se o nome de função orgânica. Para identificar a presença de uma função orgânica numa determinada amostra, foram desenvolvidos testes com reagentes que interagem com eles provocando alteração que pode ser percebida visualmente na mistura (no caso de presença do grupo funcional específico que provoca aquela reação), gerando precipitado, mudança na coloração, turbidez, liberação de gás, etc. 2.1. Aldeídos e Cetonas Aldeídos e cetonas possuem semelhante característica estrutural: a presença de um grupo carbonila (C=O) em suas fórmulas estruturais. A diferença está no fato de as cetonas apresentam dois grupos alquil ou aril ligados à carbonila; já nos aldeídos pelo menos um desses grupos é um hidrogênio. Figura 1: Representação da fórmula estrutural de um aldeído e de uma cetona, respectivamente. Fonte: RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994. Quando comparados em relação a reatividade, os aldeídos diferenciam-se das cetonas pela facilidade com que são oxidados a ácidos carboxílicos. De um modo geral, esses compostos carbonílicos são muito reativos, e isso se deve, principalmente, ao caráter eletrofílico do grupo carbonila e à acidez dos hidrogênios ligados ao carbono alfa. 3. Materiais utilizados ● Trióxido de Cromo (CrO3) ● Água Destilada ● Ácido Sulfúrico (H2SO4) ● Ácido Clorídrico ● Cloreto de Zinco ● Bicarbonato de Sódio ● Balão Volumétrico ● Béqueres de Vários tamanhos ● Acetona 4. Metodologia 4.1 Reagentes Iniciou-se o presente experimento preparando-se todos os reagentes e soluções utilizados: 4.1.a Jones Utilizando um béquer, dissolveu-se aproximadamente 20g de trióxido de cromo em aproximadamente 60mL de água destilada, agitando-a magnéticamente. Após, adicionou-se 20mL de ácido sulfúrico formando o ácido crômico. 4.1.b Lucas Em um béquer, resfriou-se aproximadamente 10mL de ácido clorídrico. Posteriormente, em constante agitação magnética, dissolveu-se aproximadamente 16g de cloreto de zinco. 4.1.c Bicarbonato de sódio (Ácido Craboxílico) Em um béquer pesou-se aproximadamente 2,5g de Bicarbonato de Sódio. Posteriormente, adicionou-se 30mL de água destilada e mexeu a solução até que o Bicarbonato se dissolve-se completamente. Em seguida transferiu-se a solução para um balão volumétrico de 50mL e completou o balão com água destilada até que se atingisse o menisco. 4.2 Procedimento Experimental Para os testes foram preparadas 2 amostras de diferentes substâncias identificadas como A e B. 4.2.a Teste de Jones Utilizando dois tubos de ensaio identificados como A e B, pipetou-se 1 gota da amostra A no tubo A e uma gota da amostra B no tubo B adicionando-se á ambos aproximadamente 1mL de acetona pura e 6 gotas de ácido crômico. . 4.2.b Teste de Lucas Em um tubo de ensaio foram adicionadas 5 gotas da amostra que não reagiu ao teste de Jones, seguido de aproximadamente 4mL do reagente de Lucas. 4.2.c Teste do Fenol Em um tubo de ensaio adicinou-se uma pequena porção da amostra seguido de 1mL de água e 8 gotas de cloreto de Ferro e agitou-se. 4.2.d Teste da Amina Em um tubo de ensaio adicionou-se 2 gotas de amostra a ser analisada e 3 gotas de ácido sulfúrico. 4.2.e Teste do Ácido Carboxílico Em um tubo de ensaio adicionou-se uma pequena quantidade de ácido benzóico e aproximadamente 1mL de bicarbonato de sódio 5%. 5. Resultados e Discussões A Tabela 1 demonstra, de maneira geral, os resultados obtidos em cada um dos testes com as diferentes amostras disponíveis. Tabela 1: Resultado geral dos testes para cada uma das amostras verificadas. Jones Lucas Fenol Amina Ácido Carboxílico Amostra A Amostra B Amostra C 5.a Teste de Jones O teste de Jones se baseia na oxidação de álcoois primários e secundários, utilizando o ácido crómico, ácidos carboxílicos e cetonas, enquanto álcoois terciários não reagem. Assim que a oxidação ocorre é notada a formação de precipitado verde devido ao sulfato crômico. O teste de Jones também se torna útil na presença de aldeídos e fenóis, resultando em positivo. A amostra “C”, apresentou uma coloração esverdeada, comprovando que se trata de um álcool primário ou secundário. As demais amostras não apresentaram mudanças. 5.b Teste de Lucas O presente teste consiste na formação de cloretos de alquilo dada através da reação de álcoois com uma solução de cloreto de zinco em ácido clorídrico concentrado. Sob condições extremamente ácidas, os álcoois geram carbocations intermediários que reagem com o íon cloreto. A função do cloreto de zinco é agir como um catalisador, garantindo maior velocidade da reação na substituição em alcoóis orgânicos. Tal teste é utilizado para a identificação de álcool primário, secundário e terciário, levando em conta a velocidade em que ocorre a reação. A identificação ocorre pois os alcoóis com menos de seis carbonos se apresentam solúveis, enquanto os haletos correspondentes não. A formação do cloreto a partir do álcool é indicada por uma turvação imediata da mistura em casos onde há a presença de álcool terciário, enquanto a turvação leva cerca de cinco minutos para ocorrer na presença de alcoóis secundários. Na presença dos alcoóis primários a turvação praticamente não aparece. Como em primeiro momento não ocorreu nenhuma reação aparente, os tubos de ensaio foram levados para aquecimento em banho-maria. Após o aquecimento, a amostra “C” apresentou uma turvação, logoo álcool em questão é secundário. 5.c Teste do Fenol Uma das características dos fenóis é a formação de complexos coloridos com íon Fe 3+, variando entre uma coloração do azul ao vermelho. 5.e Teste do Ácido Carboxílico A solubilização da amostra na presença de bicarbonato de sódio, se provocada a liberação de CO2, indica a presença de componentes ácidos. 6. Conclusão A partir dos testes realizados com as três substâncias desconhecidas, foi possível verificar que em cada teste identificou-se um composto orgânico e um grupo funcional. O teste com 2,4 dinitrofenilhidrazina, utilizado para distinguir e identificar aldeídos e cetonas, nos mostrou com a presença de um precipitado amarelo, que a amostra C não se trata de um aldeído ou cetona, podendo ser um fenol, álcool, alceno ou éter. O teste de Tollens, realizado com as amostras A e B, a partir da formação de um espelho de prata, nos indicaram que a amostra B se tratava de um aldeído, enquanto o último teste, Iodofórmio, nos explicitou a amostra A como uma cetona metílica. Assim, podemos concluir que as funções orgânicas se tornaram claras e evidenciadas através da combinação de regentes que resultaram em precipitados, colorações diferentes, liberação de gases entre outros, para o aperfeiçoamento e melhor compreensão das semelhantes relações químicas e comportamentais que esses compostos possuem em decorrência de seu grupo funcional. 7. Referências Bibliográficas ● Allinger, N. L.; Cava, M. C.; de Jongh, D. C.; Johnson, C. R.; Lebel, N. A. e Stevens, C. L.; Química Orgânica, Editora Guanabara Dois S. A., segunda edição, Rio de Janeiro – RJ, 1976. ● Apostila do curso de Química Orgânica pertencente á FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS, FCAV – UNESP Jaboticabal, disponível em <http://javali.fcav.unesp.br/sgcd/Home/departamentos/tecnologia/LUCIANAM ARIASARAN/aula-02-de-laboratorio.pdf> Também referenciado como: goo.gl/Qjaqs1 acesso em 16/05/2017. ● BARBOSA, L. C. A.; ALMEIDA, P. G. V Introdução a química orgânica. 2. ed. São Paulo: Pearson Prentice Hall, 2004. 311 p. ISBN 8576050064. ● Identificação de Compostos Orgânicos, disponível em <goo.gl/b6nmrq> acesso em 16/05/2017. ● LOBO, Fabiana, Uso do reagente 2,4 dinitrofenilhidrazina como derivatizante na determinação de formaldeído por CG-MS, disponível em <http://www.sbq.org.br/37ra/cdrom/resumos/T0192-1.pdf>, acesso em 29 de março de 2015. ● Síntese Orgânica do Iodofórmio, disponível em <http://www.infoescola.com/quimica/sintese-organica-do-iodoformio/>, acesso em 29 de março de 2015. ● SOLOMONS, T. W.; FRYHLE, C. B. Química orgânica. 8. ed. Rio de Janeiro. Livros Técnicos e Científicos, 2005. 2v





