
Fernández, V. H .
FISIOLOGÍA DE SISTEMAS
CAPÍTULO XI
EL CORAZÓN Y SUS PROPIEDADES
ESQUEMA DEL CAPÍTULO
✓ Introducción
✓ EL CORAZÓN
• Las cámaras cardíacas
✓ EL TEJIDO MUSCULAR CARDÍACO
• Inervación del corazón
✓ PROPIEDADES CARDÍACAS
✓ AUTOMATISMO (CRONOTROPISMO) Y EL NÓDULO SENOAURICULAR
• El potencial de acción de respuesta lenta (PARL)
✓ EXCITABILIDA (BATMOTROPISMO)
• El potencial de acción de respuesta rápid a
✓ REFRACTARIEDAD CARDÍACA
✓ EL SISTEMA DE CONDUCCIÓN Y LA CONDUCTIBILIDAD
(DROMOTROPISMO)
• Alteraciones del automatismo.
• Conducción auriculoventricular alterada.
• Consecuencias de las alteraciones en el automatism o y la conducción eléctrica.
✓ PROPIEDADES MECÁNICAS
✓ LA CONTRACTILIDAD (INOTROPISMO)
• Acoplamiento excitación-contracción
• Mecánica de la célula de músculo cardiaco
• Efecto de la precarga y la ley de Frank-Starling (regulación heterométrica)
• Efecto de la poscarga sobre la contractilidad
• Efecto del estado inotrópico del miocardio
• Efecto de la frecuencia cardíaca (fenómeno de Bowditch y la regulación
homeométrica)
✓ RELAJACIÓN (LUSITROPISMO)
✓ FACTORES QUE INFLUYEN SOBRE LAS PROPIEDADES DEL CORAZÓN
✓ APLICACIONES CLÍNICO-FISIOLÓGICAS
• Bibliografía
Fernández, V. H .
OBJETIVOS DEL CAPÍTULO
1. Describir el papel del sistema cardiocirculatorio en la homeostasis del organismo.
2. Describir la m orfología funcional miocárdica (tamaño celular, disposición de los
miofilamentos y las conexiones eléctricas intercelulares y la importancia de las
características sincitiales auriculares y ventriculares).
3. Explicar las p ropiedades básicas del miocardio y la proyección funcional que se
desprende de cada una de ellas.
4. Explicar las características electrofisiológicas de las células miocárdicas de trabajo
(duración del potencial de acción y del período refractario ).
5. Explicar por qué el músculo cardíaco no se puede tetanizar.
6. Saber representar gráficamente la relación entre el p otencial de acción en un
cardiomiocito y la contracción resultante.
7. Describir los pasos en el acoplamiento entre excitación y contracción en el músculo
cardíaco en relación con el papel del calcio iónico en el control de la contracción y
relajación del músculo cardíaco.
8. Representar correctamente los diagramas de los p otenciales de acción típicos en
los diferentes tipos celulares miocárdicos.
9. Describir los canales y las corrientes iónicas que contribuyen a las fases de los
potenciales de acción cardíacos.
10. Enumerar ejemplos de sus tancias (bloqueantes de canales de calcio) que
interfieren en los m ovimientos de calcio y las modificaciones que pueden causar a
la función cardíaca.
11. Describir la secuencia normal de la activación eléctrica del co razón y el papel que
juegan las células especializadas.
12. Conocer la posib ilidad de la existencia de vías anóm alas y su repercusión fun cional.
13. Analizar la im portancia del nódu lo auriculo ventricular (unión
auriculoventricular) sobre la conducción del impulso eléctrico cardíaco desde
aurículas a ventrículos.
14. Comparar las diferentes velocidades que ocurren en el sistema d e conducción y
conocer su importancia funcional.
15. Comprender los mecanismos que determinan la ritmicidad de varios tip os
celulares miocárdicos.
16. Indicar la existencia de otros grupos celulares autoexcitables como potenciales
marcapasos ectópicos, así como las condiciones necesarias para que aparezcan.
17. Explicar la influencia d e los sistemas n erviosos simpático y parasimpático sobre la
función cardiaca, y los mecanismos iónicos de sus efectos sobre el miocardio
contráctil y sobre las células marcapasos.
18. Describir cóm o la mod ificación del potencial de reposo por daño celular, altera los
eventos iónicos en la despolarización y la repolarización.

Fernández, V. H .
318
EL CORAZÓN Y SUS PROPIEDADES
Introducción
El sistema cardiovascular (SCV) sirve para suministrar un rápido transporte de
nutrientes a los tejidos del cuerpo y una rápida eli minación de los productos de desecho. En
organismos más pequ eños y menos complejos que el cuerpo humano, no existe este sistema
porque pueden cubrir sus necesidades por difusión simple.
Dado que el LI es el ambiente inmediato de células individuales, el bienestar de ést as depende
de los mecanismos homeostáticos que la r egulan y esta tarea se logra mediante exposición
continua del LI al LP circulante en continuo recambio.
Conforme la sangre pasa a través de c apilares, se intercambian solutos entre el plasma y el LI
por difusión. El resultado neto de la difusión transcapilar siempre es que el LI tiende a adoptar
la composición de la sangre que llega.
El control de la composición del LI se desarrolla gracias a las siguientes condiciones:
1) Un control adecuado del flujo sanguíneo a través de los capilares tisulares.
2) Control de la composición química de la sangre arterial.
3) Acorta las distancias de difusión entre los capilares y las células.
Por consiguiente, las sustancias son transportadas entre ó rganos mediante el proceso de
convección, por medio del cual las sustancias se mueven junto con el flujo sanguíneo,
simplemente porque están contenidas en la sangre y es un proceso acti vo cuya energía es
proporcionada por el corazón.
La evolución del sistema cardiovascular ha proporcionado un medio que f acilita el proceso de
difusión, permitiendo el desarrollo de organismos de mayor tamaño, favoreciendo a l os
nutrientes de esta manera a:
✓ Difundirse por el sistema desde sus fuentes (p. ej., oxígeno desde los alvéolos).
✓ Recorrer grandes distancias rápidamente.
✓ Difundirse en los tejidos en los que son necesarios (p. ej., oxígeno en el músculo que
trabaja).
El sistema cardiovascular comprende esencialmente:
✓ Un órgano central de impulsión: el corazón.
✓ Un conjunto de conductos, de estructura y propiedades diferentes: las arterias, las v enas,
los vasos capilares y los vasos linfáticos.
Las principales funciones del sistema cardiovascular son:
✓ Transporte rápido de nutrientes (oxígeno, aminoá cidos, glucosa, ácidos grasos, agua,
etc.).
✓ Eliminación de los productos de desecho del me tabolismo (dióxido de carbono, urea,
creatinina, etc.).
✓ Control hormonal, transportando las hormonas a sus órganos diana y secretando sus
propias hormonas (p. ej., péptido natriurético auricular).
✓ Regulación de la temperatura, controlando la dist ribución de calor entre e l centro del
organismo y la piel.
✓ Reproducción, dando lugar a la erección del p ene y a la nutrición del f eto a través de un
complejo sistema de flujo de sangre placentario.
✓ Defensa del huésped, transportando células inmunitarias, antígenos y otros mediadores
(p. ej., anticuerpos).
Fernández, V. H .
319
EL CORAZÓN
El corazón es un órgano muscular compuesto por dos mitades diferenciadas: un
“corazón derecho” y un “corazón izquierdo”. En cada una de estas mitade s se encuentran dos
cavidades: una aurícula (atrio) y un ventrículo.
Mientras que el corazón derecho y el corazón izquierdo están s eparados uno de otro por un
tabique, cada una de las aurículas comunica con el ventrículo correspondiente por un orificio
provisto de v álvulas que aseguran, en cada mitad del corazón, una circulación sanguínea en
sentido único. A las aurículas llegan las venas, de los ventrículos parten las arterias.
El corazón es un músculo hueco que circunscrib e cavidades en las cuales circula la sangre.
Cuando se relaja (diástole), el corazón atrae hacia sí la sangre que circula en las venas. Cuando
se contrae (sístole) expulsa la sangre hacia las arterias: aorta o tronco pulmonar.
Básicamente, está formado por un músculo con propiedades particul ares denominado
miocardio, que se halla tapizado interiormente por el endocardio y exteriormente por el
epicardio. El corazón está rodeado por el pericardio, conjunto fibroseroso que lo separa de los
órganos vecinos.
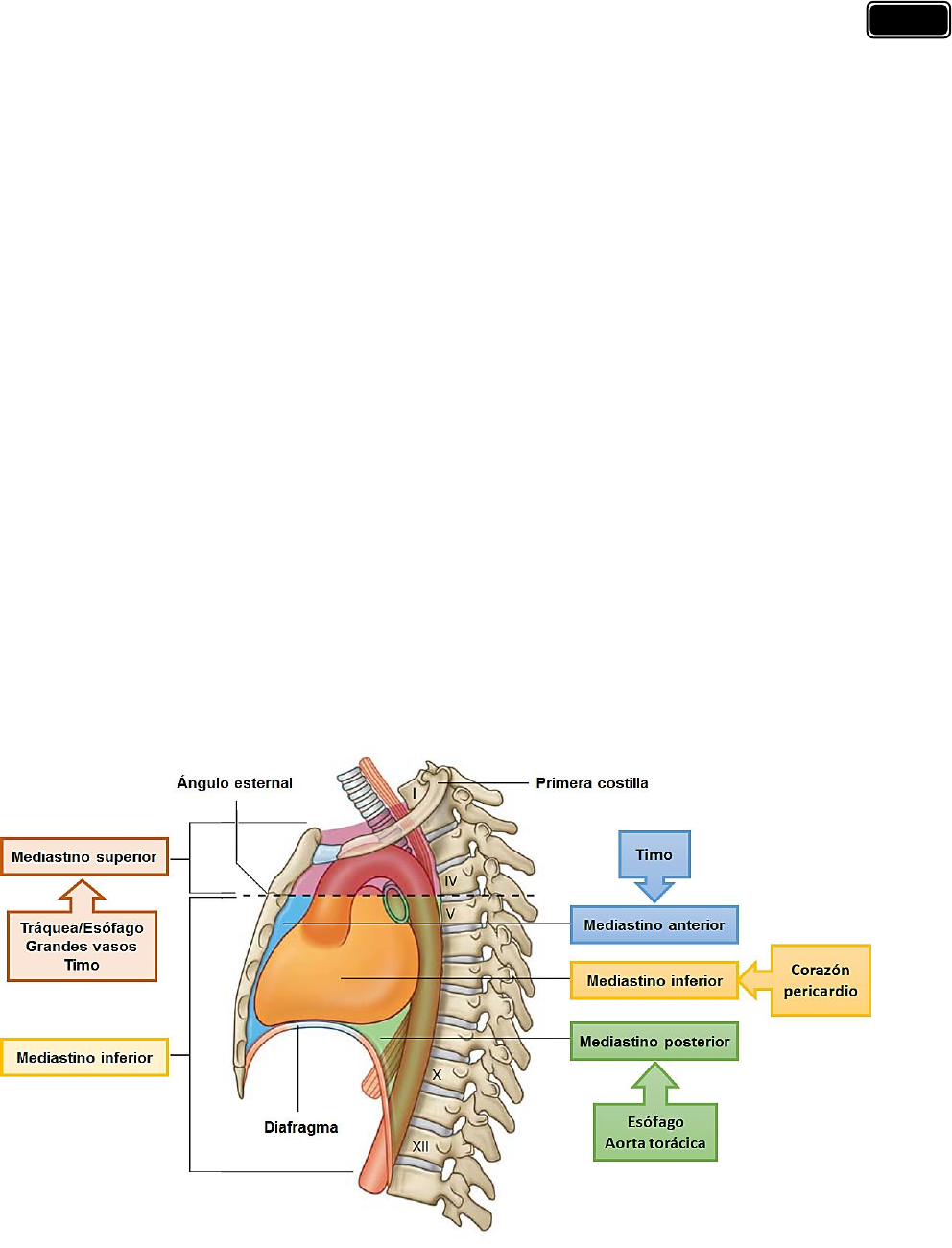
El corazón está en el mediastino medio y tiene las siguientes relaciones:
✓ Por arriba, los grandes vasos y los bronquios.
✓ Por debajo, el diafragma.
✓ Lateralmente, por las pleuras y los pulmones.
✓ Por delante, el timo.
✓ Por detrás, el esófago.
Si se considera la im portancia d e su función, el corazón es un órgano relati vamente pequeño,
casi del mismo tamaño ( pero no de la misma for ma) que un puño cerrado. Mide alrededor d e
12 cm de largo, 9 cm en su punto más ancho y 6 cm de espesor.
El corazón del hombre es más volum inoso que el de la mujer. Al n acer, pesa 25 g; a los 10 años,
entre 100 y 125 g y en el adulto entre 200 y 350 g, siendo de unos 250 g en una mujer y 300 g
en el hombre, aproximadamente. Este peso aumenta con la talla y con la capacidad torácica. El
Fernández, V. H .
320
volumen depende del trabajo muscular y de los esfuerzos físicos a los que el individuo está
sometido.
El corazón se proyecta en el segmento comprendido entre la 4ª y la 8ª apófisis espinosa de las
vértebras torácicas (vértebras cardíacas). Situado en la lí nea m ediana, se d esarrolla sobre todo
a la izquierda de esta línea.
Tiene la forma de un cono o una pirámide y se reconoce una base, dirigida hacia atrás, arriba y
algo a la derecha, y un vértice o punta (ápex), situado adelante y a la izquierda.
La línea que une el vértice del corazón con el centro de su base está orientada de abajo hacia
arriba y de adelante hacia atrás. El eje general del corazón se acerca más a la horizontal que a
la vertical.
Dado que la forma global y orientación del corazón es la de una pirámide caída y que descansa
sobre uno de sus lados, los lados de la pirámide están formados por:
✓ Una cara diafragmática (inferior) sobre la que descansa la pirámide.
✓ Una cara anterior (esternocostal) orientada anteriormente.
✓ Una cara pulmonar derecha.
✓ Una cara pulmonar izquierda.
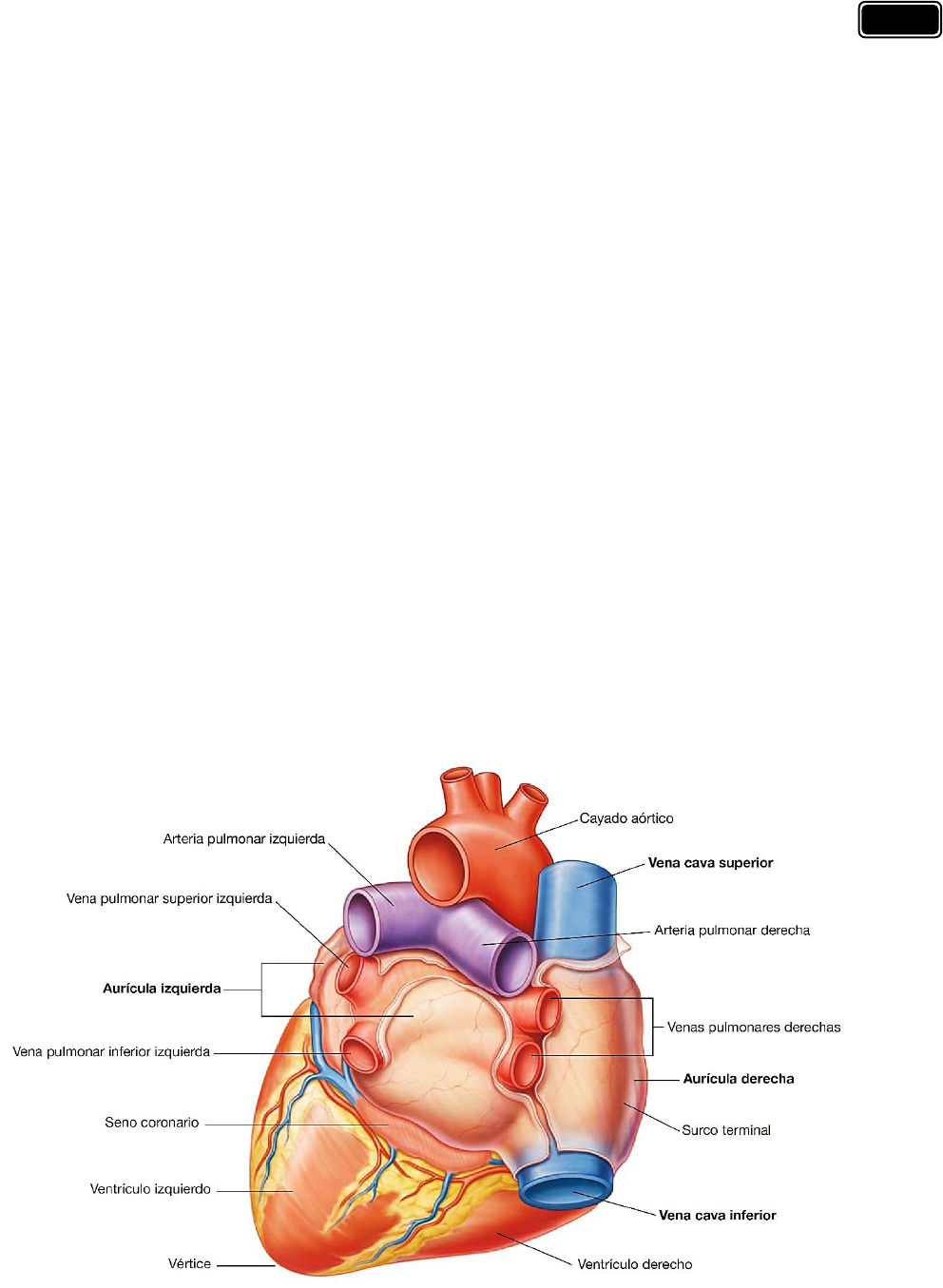
La base del corazón es un cuadrilátero y se dirige posteriormente. Está formada por:
✓ La aurícula izquierda.
✓ Una pequeña porción de la aurícula derecha.
✓ La parte proximal de las grandes venas (venas cavas superior e inferior y venas
pulmonares)
Debido a que los grandes vasos penetran por la base del corazón, las venas pulmonares entran
en el lado derecho e izquierdo de la aurícula izqui erda y las venas cav a superior e inferior por
los extremos superior e inferior de la aurícula derecha, la base del corazón está fijada
Fernández, V. H .
321
posteriormente a la pared del pericardio, frente a los cuerpos de las vértebras TV a TVIII (TVI
a TIX en bipedestación).
Desde la base el corazón se proyecta hacia delante, hacia abajo y a la izquierda, terminando en
el vértice. El vértice del corazón está fo rmado por la parte inferolateral del ventrículo izquierdo
y se encuentra profundo al quinto espacio intercostal izquierdo, a 8 o 9 cm de la línea
medioesternal.
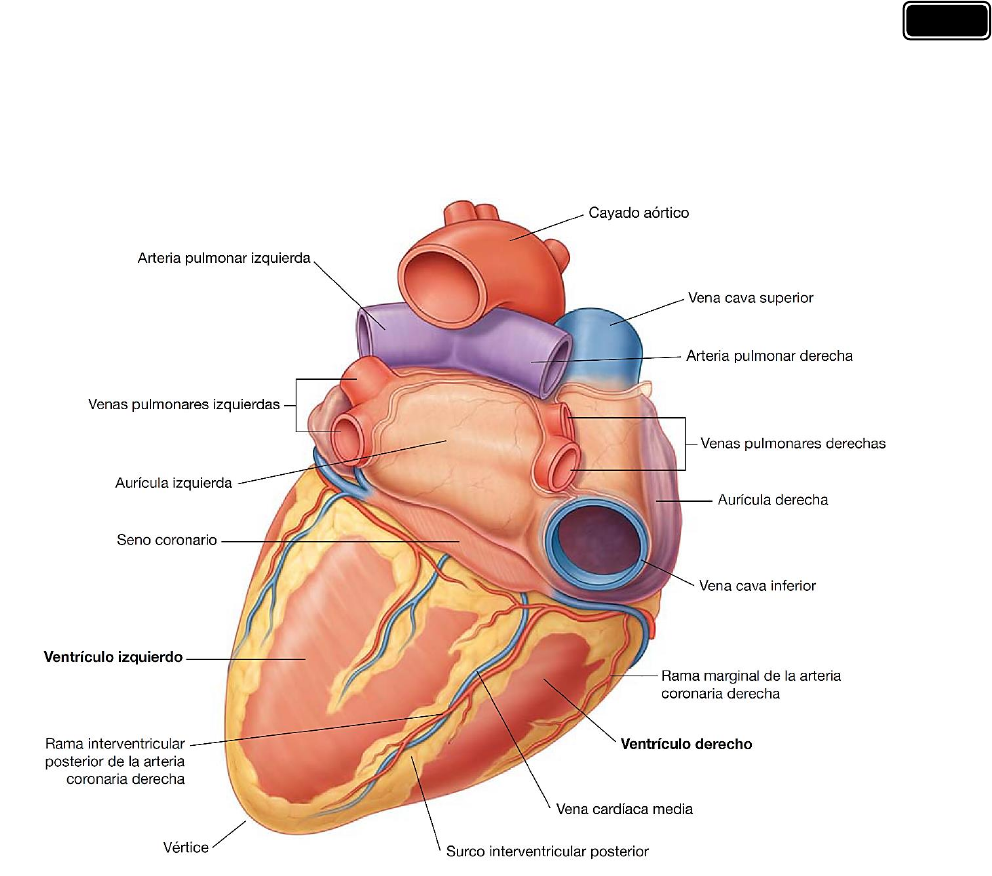
El corazón en posi ción anatómica descansa sobre la cara dia fragmática, que está formada por
el ventrículo izquierdo y una pequeña porción del ventrículo derecho sepa rados po r el sur co
interventricular posterior. Esta superficie se orienta inferiormente sobre el diafragma, está
separada de la base del corazón por el seno coronario y se prolonga desde la base al vértice del
corazón.
La cara pulmonar izquierda está orientada hacia el pulmón izquierdo, es amplia y convexa y
está formada por el ventrículo izquierdo y una parte de la aurícula izquierda.
La cara pulmonar derecha se orienta hacia el pulmón derecho, es amplia y convexa y está
formada por la aurícula derecha.
Algunas descripciones generales de la orientación cardíaca se refieren a los bordes o márgenes
derecho, izquierdo, inferior (agudo) y obtusos:
✓ Los m árgenes derecho e izquierdo son los mi smos que las caras pulmonares derecha
e izquierda del pulmón.
✓ El margen inferior s e caracteriza po r ser un bord e agudo entre las sup erficies anterior
y diafragmática d el coraz ón, está constituido en su mayor parte por el ventrículo derecho
y una pequeña porción del ventrículo izquierdo cerca del vértice.
✓ El m argen obtuso separa las superficies pulmonares anterio r e izquierda, es redondeado
y se extiende desde la au rícula izquierda hasta el vértice del corazón y está constituido
Fernández, V. H .
322
en su mayor parte por el ventrículo izquierdo y superiormente por una pequeña porción
de la aurícula izquierda.
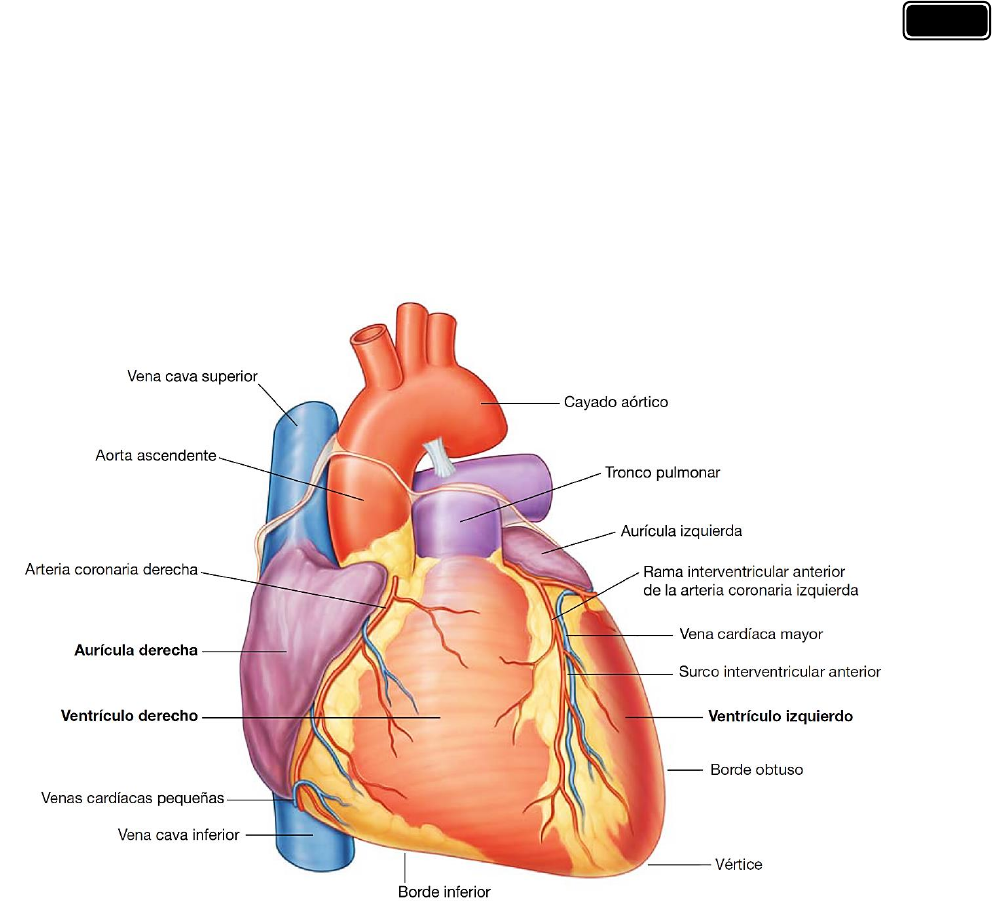
Los tabiques internos dividen el corazón en cuatro cámaras (dos aurículas y dos ventrículos) y
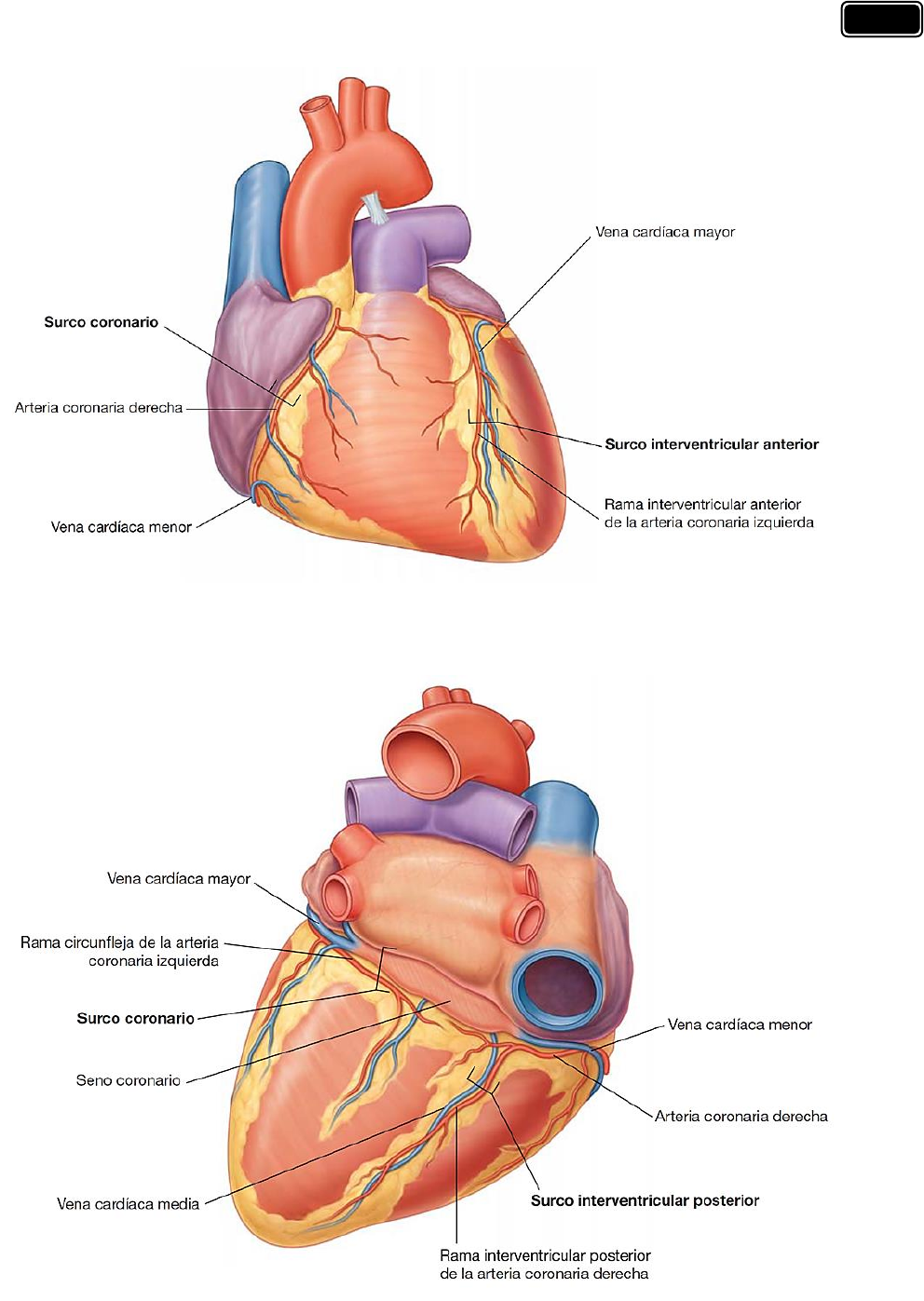
dan lugar a depresiones externas o superficiales denominadas surcos.
El surco coronario rodea al corazón, separando las aurículas de los ventrículos. En su recorrido
en torno al corazón, con tiene a la arteria coronaria derecha, la vena cardíaca menor, el seno
coronario y la rama circunfleja de la arteria coronaria izquierda. En la cara anterior de cada
aurícula se encuentra una estructura semejante a una pequeña bolsa denominada orejuela.
Los surcos interventriculares anterior y posterior separan los dos ventrículos; el surco
interventricular anterior se encuentra en la cara anterior del corazón y contiene la arteria
interventricular anterior y la vena cardíaca mayor o magna, y el surco interventricular
posterior se encuentra en la superficie diafragmática del corazón y contiene la arteria
interventricular posterior y la vena c ardíaca media o interventricular posterior. Estos surcos se
continúan inferiormente, a la derecha del vértice cardíaco.
Fernández, V. H .
323
Fernández, V. H .
324
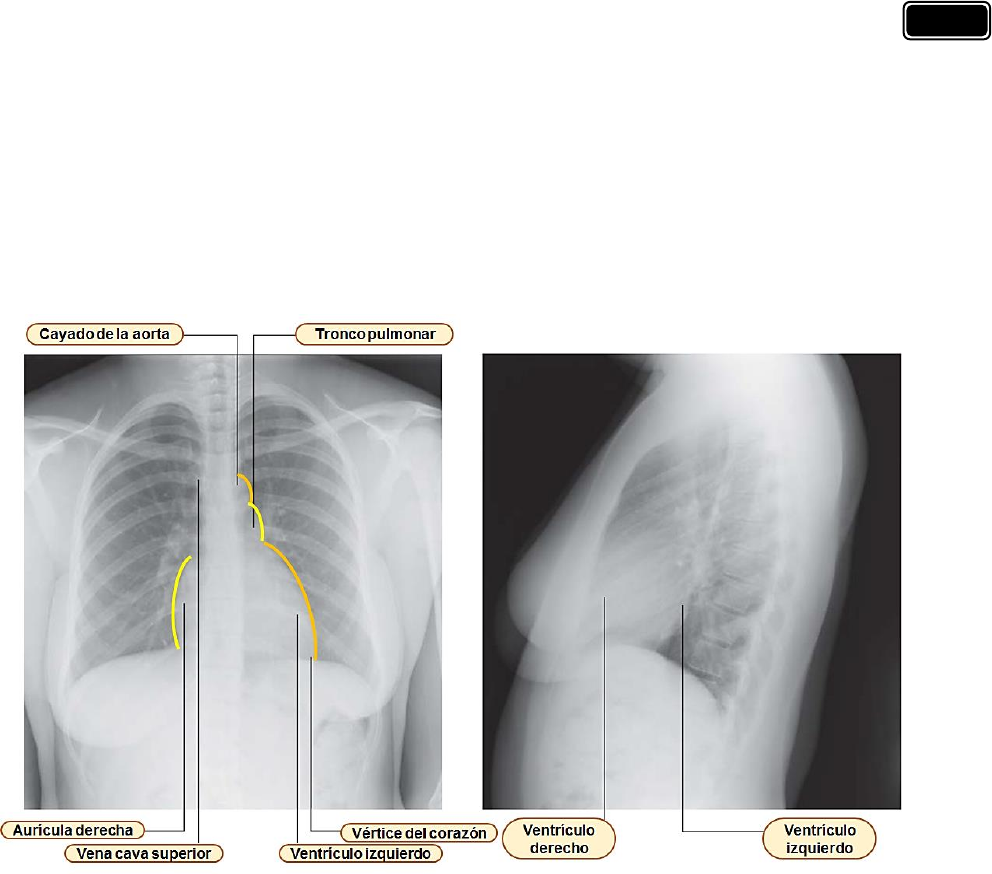
Para la evaluación radiológica es fundamental un conocimiento detalla do de las estructuras
que definen los bord es de l corazón. El borde de recho, en una proyección posteroanterior simple,
está formado por la vena cava superior, l a aurícula derecha y la vena cava inferior. El bo rde
izquierdo en una proy ección sim ilar está formado por el cayado aórtico, la arteria pulmonar y
el ventrículo izquierdo. El borde inferior de esta proyección radiológica con siste en el ventrículo
derecho y el vértice del ventrículo izquierdo. En la proyección lateral el ventrículo derecho está
situado anteriormente y la aurícula izquierda se visualiza posteriormente.
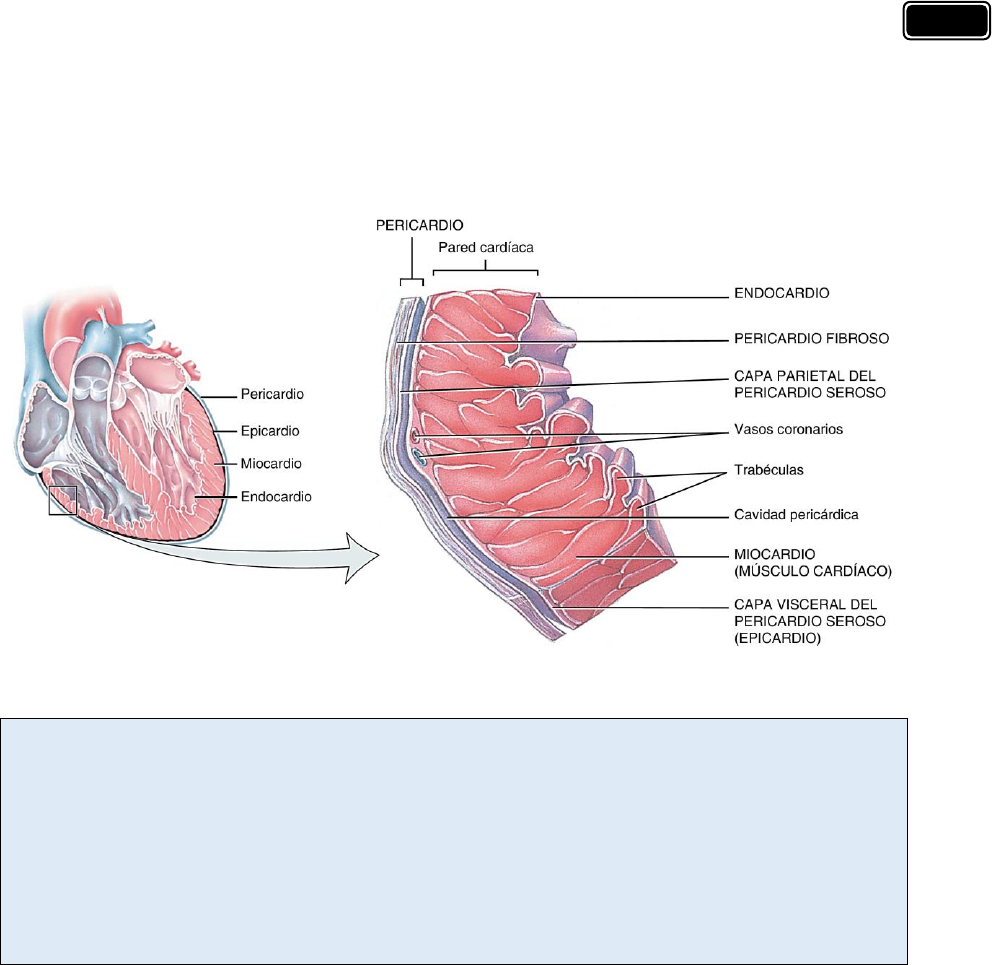
La pared cardíaca está compuesta de tres capas. De afuera hacia adentro son las siguientes:
✓ El epicardio es la capa visceral de la s erosa pe ricárdica que se adhiere a la superficie
externa del corazón. Se compone de una sola capa de células mesoteliales, así como de
tejido conjuntivo adiposo subyacente. Los vasos sanguíneos y los nervios que irrigan e
inervan el corazón transcurren en el epi cardio y están rodeados por tejido adiposo que
protege el corazón en la cavidad pericárdica. El epicardio se refleja a la altura de los
grandes v asos que llega n y abandonan el c orazón como la capa p arietal de la serosa
pericárdica, que tapiza l a superficie interna del pericardio que rodea el corazón y las
raíces de los grandes vasos. Por lo tanto, existe un espacio potencial que contiene unos
15 a 50 ml de líquido seroso pericárdico entre las capas visceral y parietal de la se rosa
pericárdica. Este espacio se conoce como cavidad pericárdica; su revesti miento es de
células mesoteliales.
✓ El miocardio está formado por músculo cardíaco, el componente principal del corazón.
El miocardio de las aurículas es sustancialmente más delgado que el de los ventrículos.
Las aurículas reciben la sangre d esde las venas grandes y la entregan a los ventrículos
contiguos, un proceso que requiere una presión relativamente baja. El miocardio de los
ventrículos es sustancialmente más grueso debido a la mayor presión necesaria para
bombear la sangre a través de las circulaciones pulmonar y sistémica.
✓ El endocardio consiste de un a c apa int erna de endotelio y tejido conjuntivo
subendotelial, una capa media de tejido conjuntivo y células de músculo liso y una capa
Fernández, V. H .
325
más profunda de tejido conjuntivo, que también se llama capa subendocárdica. Esta
última es continua con el tejido conjuntivo del miocardio. El sistema de conducción del
corazón se encuentra en la capa subendocárdica del endocardio.
Correlato entre la fisiología y la clínica
El trastorno en el que se acumula con rapidez un exceso de líquido (sangre o derrame
pericárdico) en la cavid ad pericárdica se llama taponamiento cardíaco. L as causas comunes
son los traumatismos torácicos tanto penetrantes como romos y las roturas del miocardio o
pericarditis (inflamación del pericardio). Este es un trastorno potencialmente mortal en el
cual el líquido que s e acumula comprime el co razón e impide el llenado adecuado de las
cavidades cardíacas con la sangre. El alivio de la compresión se lo gra mediante la
pericardiocentesis (un procedimiento para drenar el líquido de la cavidad pericárdica).
Las cámaras cardíacas
La au rícula derecha recibe sangre de la ven a cava superior (VCS), l a vena cava inferior
(VCI) y el seno coronario. Las p aredes de la aurícula derecha tienen un esp esor promedio de 2
a 3 mm. La pared posterior es lisa y la pared anterior es trabeculada, debido a la presencia de
crestas musculares denominadas músculos pectíneos, que también se extienden dentro de la
orejuela. Entre la aurícula derecha y la izquierda se encuentra un tabique delgado, denominado
septum o tabiqu e interauricular. Una formación anatómica importante de este tabique es la
fosa oval, depresión oval remanente del foramen ovale, una comunicación interauricular en el
corazón fetal que normalmente se cierra luego del nacimiento.
La sangre p asa desde l a aurícula derecha hacia el ventrículo derecho a través de la válvula
tricúspide, que posee tres valvas o cúspides. También se denomina válvula auriculoventricular
o atrioventricular d erecha. Estas válvulas cardíacas están compuestas de tejido conectivo denso ,
cubierto por endocardio.
El ventrículo derecho tiene una pared de 4 a 5 mm y forma la mayor parte de la cara anterior
del corazón. En su interior, contiene una serie de relieves constituidos por haces de fibras
musculares cardíacas denominadas trabéculas carnosas y algunas de estas trabéculas contienen
Vista previa del material en texto
Fernández, V. H. FISIOLOGÍA DE SISTEMAS CAPÍTULO XI EL CORAZÓN Y SUS PROPIEDADES ESQUEMA DEL CAPÍTULO ✓ Introducción ✓ EL CORAZÓN • Las cámaras cardíacas ✓ EL TEJIDO MUSCULAR CARDÍACO • Inervación del corazón ✓ PROPIEDADES CARDÍACAS ✓ AUTOMATISMO (CRONOTROPISMO) Y EL NÓDULO SENOAURICULAR • El potencial de acción de respuesta lenta (PARL) ✓ EXCITABILIDA (BATMOTROPISMO) • El potencial de acción de respuesta rápida ✓ REFRACTARIEDAD CARDÍACA ✓ EL SISTEMA DE CONDUCCIÓN Y LA CONDUCTIBILIDAD (DROMOTROPISMO) • Alteraciones del automatismo. • Conducción auriculoventricular alterada. • Consecuencias de las alteraciones en el automatismo y la conducción eléctrica. ✓ PROPIEDADES MECÁNICAS ✓ LA CONTRACTILIDAD (INOTROPISMO) • Acoplamiento excitación-contracción • Mecánica de la célula de músculo cardiaco • Efecto de la precarga y la ley de Frank-Starling (regulación heterométrica) • Efecto de la poscarga sobre la contractilidad • Efecto del estado inotrópico del miocardio • Efecto de la frecuencia cardíaca (fenómeno de Bowditch y la regulación homeométrica) ✓ RELAJACIÓN (LUSITROPISMO) ✓ FACTORES QUE INFLUYEN SOBRE LAS PROPIEDADES DEL CORAZÓN ✓ APLICACIONES CLÍNICO-FISIOLÓGICAS • Bibliografía Fernández, V. H. OBJETIVOS DEL CAPÍTULO 1. Describir el papel del sistema cardiocirculatorio en la homeostasis del organismo. 2. Describir la morfología funcional miocárdica (tamaño celular, disposición de los miofilamentos y las conexiones eléctricas intercelulares y la importancia de las características sincitiales auriculares y ventriculares). 3. Explicar las propiedades básicas del miocardio y la proyección funcional que se desprende de cada una de ellas. 4. Explicar las características electrofisiológicas de las células miocárdicas de trabajo (duración del potencial de acción y del período refractario). 5. Explicar por qué el músculo cardíaco no se puede tetanizar. 6. Saber representar gráficamente la relación entre el potencial de acción en un cardiomiocito y la contracción resultante. 7. Describir los pasos en el acoplamiento entre excitación y contracción en el músculo cardíaco en relación con el papel del calcio iónico en el control de la contracción y relajación del músculo cardíaco. 8. Representar correctamente los diagramas de los potenciales de acción típicos en los diferentes tipos celulares miocárdicos. 9. Describir los canales y las corrientes iónicas que contribuyen a las fases de los potenciales de acción cardíacos. 10. Enumerar ejemplos de sustancias (bloqueantes de canales de calcio) que interfieren en los movimientos de calcio y las modificaciones que pueden causar a la función cardíaca. 11. Describir la secuencia normal de la activación eléctrica del corazón y el papel que juegan las células especializadas. 12. Conocer la posibilidad de la existencia de vías anómalas y su repercusión funcional. 13. Analizar la importancia del nódulo auriculoventricular (unión auriculoventricular) sobre la conducción del impulso eléctrico cardíaco desde aurículas a ventrículos. 14. Comparar las diferentes velocidades que ocurren en el sistema de conducción y conocer su importancia funcional. 15. Comprender los mecanismos que determinan la ritmicidad de varios tipos celulares miocárdicos. 16. Indicar la existencia de otros grupos celulares autoexcitables como potenciales marcapasos ectópicos, así como las condiciones necesarias para que aparezcan. 17. Explicar la influencia de los sistemas nerviosos simpático y parasimpático sobre la función cardiaca, y los mecanismos iónicos de sus efectos sobre el miocardio contráctil y sobre las células marcapasos. 18. Describir cómo la modificación del potencial de reposo por daño celular, altera los eventos iónicos en la despolarización y la repolarización. Fernández, V. H. 318 EL CORAZÓN Y SUS PROPIEDADES Introducción El sistema cardiovascular (SCV) sirve para suministrar un rápido transporte de nutrientes a los tejidos del cuerpo y una rápida eliminación de los productos de desecho. En organismos más pequeños y menos complejos que el cuerpo humano, no existe este sistema porque pueden cubrir sus necesidades por difusión simple. Dado que el LI es el ambiente inmediato de células individuales, el bienestar de éstas depende de los mecanismos homeostáticos que la regulan y esta tarea se logra mediante exposición continua del LI al LP circulante en continuo recambio. Conforme la sangre pasa a través de capilares, se intercambian solutos entre el plasma y el LI por difusión. El resultado neto de la difusión transcapilar siempre es que el LI tiende a adoptar la composición de la sangre que llega. El control de la composición del LI se desarrolla gracias a las siguientes condiciones: 1) Un control adecuado del flujo sanguíneo a través de los capilares tisulares. 2) Control de la composición química de la sangre arterial. 3) Acorta las distancias de difusión entre los capilares y las células. Por consiguiente, las sustancias son transportadas entre órganos mediante el proceso de convección, por medio del cual las sustancias se mueven junto con el flujo sanguíneo, simplemente porque están contenidas en la sangre y es un proceso activo cuya energía es proporcionada por el corazón. La evolución del sistema cardiovascular ha proporcionado un medio que facilita el proceso de difusión, permitiendo el desarrollo de organismos de mayor tamaño, favoreciendo a los nutrientes de esta manera a: ✓ Difundirse por el sistema desde sus fuentes (p. ej., oxígeno desde los alvéolos). ✓ Recorrer grandes distancias rápidamente. ✓ Difundirse en los tejidos en los que son necesarios (p. ej., oxígeno en el músculo que trabaja). El sistema cardiovascular comprende esencialmente: ✓ Un órgano central de impulsión: el corazón. ✓ Un conjunto de conductos, de estructura y propiedades diferentes: las arterias, las venas, los vasos capilares y los vasos linfáticos. Las principales funciones del sistema cardiovascular son: ✓ Transporte rápido de nutrientes (oxígeno, aminoácidos, glucosa, ácidos grasos, agua, etc.). ✓ Eliminación de los productos de desecho del metabolismo (dióxido de carbono, urea, creatinina, etc.). ✓ Control hormonal, transportando las hormonas a sus órganos diana y secretando sus propias hormonas (p. ej., péptido natriurético auricular). ✓ Regulación de la temperatura, controlando la distribución de calor entre el centro del organismo y la piel. ✓ Reproducción, dando lugar a la erección del pene y a la nutrición del feto a través de un complejo sistema de flujo de sangre placentario. ✓ Defensa del huésped, transportando células inmunitarias, antígenos y otros mediadores (p. ej., anticuerpos). Fernández, V. H. 319 EL CORAZÓN El corazón es un órgano muscular compuesto por dos mitades diferenciadas: un “corazón derecho” y un “corazón izquierdo”. En cada una de estas mitades se encuentran dos cavidades: una aurícula (atrio) y un ventrículo. Mientras que el corazón derecho y el corazón izquierdo están separados uno de otro por un tabique, cada una de las aurículas comunica con el ventrículo correspondiente por un orificio provisto de válvulas que aseguran, en cada mitad del corazón, una circulación sanguínea en sentido único. A las aurículas llegan las venas, de los ventrículos parten las arterias. El corazón es un músculo hueco que circunscribe cavidades en las cuales circula la sangre. Cuando se relaja (diástole), el corazón atrae hacia sí la sangre que circula en las venas. Cuando se contrae (sístole) expulsa la sangre hacia las arterias: aorta o tronco pulmonar. Básicamente, está formado por un músculo con propiedades particulares denominado miocardio, que se halla tapizado interiormente por el endocardio y exteriormente por el epicardio. El corazón está rodeado por el pericardio,conjunto fibroseroso que lo separa de los órganos vecinos. El corazón está en el mediastino medio y tiene las siguientes relaciones: ✓ Por arriba, los grandes vasos y los bronquios. ✓ Por debajo, el diafragma. ✓ Lateralmente, por las pleuras y los pulmones. ✓ Por delante, el timo. ✓ Por detrás, el esófago. Si se considera la importancia de su función, el corazón es un órgano relativamente pequeño, casi del mismo tamaño (pero no de la misma forma) que un puño cerrado. Mide alrededor de 12 cm de largo, 9 cm en su punto más ancho y 6 cm de espesor. El corazón del hombre es más voluminoso que el de la mujer. Al nacer, pesa 25 g; a los 10 años, entre 100 y 125 g y en el adulto entre 200 y 350 g, siendo de unos 250 g en una mujer y 300 g en el hombre, aproximadamente. Este peso aumenta con la talla y con la capacidad torácica. El Fernández, V. H. 320 volumen depende del trabajo muscular y de los esfuerzos físicos a los que el individuo está sometido. El corazón se proyecta en el segmento comprendido entre la 4ª y la 8ª apófisis espinosa de las vértebras torácicas (vértebras cardíacas). Situado en la línea mediana, se desarrolla sobre todo a la izquierda de esta línea. Tiene la forma de un cono o una pirámide y se reconoce una base, dirigida hacia atrás, arriba y algo a la derecha, y un vértice o punta (ápex), situado adelante y a la izquierda. La línea que une el vértice del corazón con el centro de su base está orientada de abajo hacia arriba y de adelante hacia atrás. El eje general del corazón se acerca más a la horizontal que a la vertical. Dado que la forma global y orientación del corazón es la de una pirámide caída y que descansa sobre uno de sus lados, los lados de la pirámide están formados por: ✓ Una cara diafragmática (inferior) sobre la que descansa la pirámide. ✓ Una cara anterior (esternocostal) orientada anteriormente. ✓ Una cara pulmonar derecha. ✓ Una cara pulmonar izquierda. La base del corazón es un cuadrilátero y se dirige posteriormente. Está formada por: ✓ La aurícula izquierda. ✓ Una pequeña porción de la aurícula derecha. ✓ La parte proximal de las grandes venas (venas cavas superior e inferior y venas pulmonares) Debido a que los grandes vasos penetran por la base del corazón, las venas pulmonares entran en el lado derecho e izquierdo de la aurícula izquierda y las venas cava superior e inferior por los extremos superior e inferior de la aurícula derecha, la base del corazón está fijada Fernández, V. H. 321 posteriormente a la pared del pericardio, frente a los cuerpos de las vértebras TV a TVIII (TVI a TIX en bipedestación). Desde la base el corazón se proyecta hacia delante, hacia abajo y a la izquierda, terminando en el vértice. El vértice del corazón está formado por la parte inferolateral del ventrículo izquierdo y se encuentra profundo al quinto espacio intercostal izquierdo, a 8 o 9 cm de la línea medioesternal. El corazón en posición anatómica descansa sobre la cara diafragmática, que está formada por el ventrículo izquierdo y una pequeña porción del ventrículo derecho separados por el surco interventricular posterior. Esta superficie se orienta inferiormente sobre el diafragma, está separada de la base del corazón por el seno coronario y se prolonga desde la base al vértice del corazón. La cara pulmonar izquierda está orientada hacia el pulmón izquierdo, es amplia y convexa y está formada por el ventrículo izquierdo y una parte de la aurícula izquierda. La cara pulmonar derecha se orienta hacia el pulmón derecho, es amplia y convexa y está formada por la aurícula derecha. Algunas descripciones generales de la orientación cardíaca se refieren a los bordes o márgenes derecho, izquierdo, inferior (agudo) y obtusos: ✓ Los márgenes derecho e izquierdo son los mismos que las caras pulmonares derecha e izquierda del pulmón. ✓ El margen inferior se caracteriza por ser un borde agudo entre las superficies anterior y diafragmática del corazón, está constituido en su mayor parte por el ventrículo derecho y una pequeña porción del ventrículo izquierdo cerca del vértice. ✓ El margen obtuso separa las superficies pulmonares anterior e izquierda, es redondeado y se extiende desde la aurícula izquierda hasta el vértice del corazón y está constituido Fernández, V. H. 322 en su mayor parte por el ventrículo izquierdo y superiormente por una pequeña porción de la aurícula izquierda. Los tabiques internos dividen el corazón en cuatro cámaras (dos aurículas y dos ventrículos) y dan lugar a depresiones externas o superficiales denominadas surcos. El surco coronario rodea al corazón, separando las aurículas de los ventrículos. En su recorrido en torno al corazón, contiene a la arteria coronaria derecha, la vena cardíaca menor, el seno coronario y la rama circunfleja de la arteria coronaria izquierda. En la cara anterior de cada aurícula se encuentra una estructura semejante a una pequeña bolsa denominada orejuela. Los surcos interventriculares anterior y posterior separan los dos ventrículos; el surco interventricular anterior se encuentra en la cara anterior del corazón y contiene la arteria interventricular anterior y la vena cardíaca mayor o magna, y el surco interventricular posterior se encuentra en la superficie diafragmática del corazón y contiene la arteria interventricular posterior y la vena cardíaca media o interventricular posterior. Estos surcos se continúan inferiormente, a la derecha del vértice cardíaco. Fernández, V. H. 323 Fernández, V. H. 324 Para la evaluación radiológica es fundamental un conocimiento detallado de las estructuras que definen los bordes del corazón. El borde derecho, en una proyección posteroanterior simple, está formado por la vena cava superior, la aurícula derecha y la vena cava inferior. El borde izquierdo en una proyección similar está formado por el cayado aórtico, la arteria pulmonar y el ventrículo izquierdo. El borde inferior de esta proyección radiológica consiste en el ventrículo derecho y el vértice del ventrículo izquierdo. En la proyección lateral el ventrículo derecho está situado anteriormente y la aurícula izquierda se visualiza posteriormente. La pared cardíaca está compuesta de tres capas. De afuera hacia adentro son las siguientes: ✓ El epicardio es la capa visceral de la serosa pericárdica que se adhiere a la superficie externa del corazón. Se compone de una sola capa de células mesoteliales, así como de tejido conjuntivo adiposo subyacente. Los vasos sanguíneos y los nervios que irrigan e inervan el corazón transcurren en el epicardio y están rodeados por tejido adiposo que protege el corazón en la cavidad pericárdica. El epicardio se refleja a la altura de los grandes vasos que llegan y abandonan el corazón como la capa parietal de la serosa pericárdica, que tapiza la superficie interna del pericardio que rodea el corazón y las raíces de los grandes vasos. Por lo tanto, existe un espacio potencial que contiene unos 15 a 50 ml de líquido seroso pericárdico entre las capas visceral y parietal de la serosa pericárdica. Este espacio se conoce como cavidad pericárdica; su revestimiento es de células mesoteliales. ✓ El miocardio está formado por músculo cardíaco, el componente principal del corazón. El miocardio de las aurículas es sustancialmente más delgado que el de los ventrículos. Las aurículas reciben la sangre desde las venas grandes y la entregan a los ventrículos contiguos, un proceso que requiere una presión relativamente baja. El miocardio de los ventrículos es sustancialmente más grueso debido a la mayor presión necesaria para bombear la sangre a través de las circulaciones pulmonar y sistémica. ✓ El endocardio consiste de una capa interna de endotelio y tejido conjuntivo subendotelial, una capa media de tejido conjuntivo y células de músculoliso y una capa Fernández, V. H. 325 más profunda de tejido conjuntivo, que también se llama capa subendocárdica. Esta última es continua con el tejido conjuntivo del miocardio. El sistema de conducción del corazón se encuentra en la capa subendocárdica del endocardio. Correlato entre la fisiología y la clínica El trastorno en el que se acumula con rapidez un exceso de líquido (sangre o derrame pericárdico) en la cavidad pericárdica se llama taponamiento cardíaco. Las causas comunes son los traumatismos torácicos tanto penetrantes como romos y las roturas del miocardio o pericarditis (inflamación del pericardio). Este es un trastorno potencialmente mortal en el cual el líquido que se acumula comprime el corazón e impide el llenado adecuado de las cavidades cardíacas con la sangre. El alivio de la compresión se logra mediante la pericardiocentesis (un procedimiento para drenar el líquido de la cavidad pericárdica). Las cámaras cardíacas La aurícula derecha recibe sangre de la vena cava superior (VCS), la vena cava inferior (VCI) y el seno coronario. Las paredes de la aurícula derecha tienen un espesor promedio de 2 a 3 mm. La pared posterior es lisa y la pared anterior es trabeculada, debido a la presencia de crestas musculares denominadas músculos pectíneos, que también se extienden dentro de la orejuela. Entre la aurícula derecha y la izquierda se encuentra un tabique delgado, denominado septum o tabique interauricular. Una formación anatómica importante de este tabique es la fosa oval, depresión oval remanente del foramen ovale, una comunicación interauricular en el corazón fetal que normalmente se cierra luego del nacimiento. La sangre pasa desde la aurícula derecha hacia el ventrículo derecho a través de la válvula tricúspide, que posee tres valvas o cúspides. También se denomina válvula auriculoventricular o atrioventricular derecha. Estas válvulas cardíacas están compuestas de tejido conectivo denso, cubierto por endocardio. El ventrículo derecho tiene una pared de 4 a 5 mm y forma la mayor parte de la cara anterior del corazón. En su interior, contiene una serie de relieves constituidos por haces de fibras musculares cardíacas denominadas trabéculas carnosas y algunas de estas trabéculas contienen Fernández, V. H. 326 fibras que forman parte del sistema de conducción cardíaco. Las cúspides o valvas de la válvula tricúspide se conectan mediante las cuerdas tendinosas, que a su vez se conectan con los músculos papilares. El ventrículo derecho se encuentra separado del ventrículo izquierdo por el septum o tabique interventricular. La sangre pasa desde el ventrículo derecho, a través de la válvula pulmonar, hacia una gran arteria, el tronco pulmonar, que se divide en las arterias pulmonares derecha e izquierda que transportan la sangre hacia los pulmones. La aurícula izquierda forma la mayor parte de la base del corazón y recibe sangre proveniente de los pulmones, por medio de cuatro venas pulmonares. Al igual que la aurícula derecha, su pared posterior es lisa. La pared anterior de la aurícula izquierda también es lisa, debido a que los músculos pectíneos están confinados a la orejuela izquierda. La sangre pasa desde la aurícula izquierda al ventrículo izquierdo, a través de la válvula bicúspide que posee dos valvas o cúspides, denominada válvula mitral o válvula auriculoventricular izquierda. El ventrículo izquierdo tiene la pared más gruesa de las cuatro cámaras (un promedio de 10 a 15 mm) y forma el vértice o ápex del corazón. Al igual que el ventrículo derecho, contiene trabéculas carnosas y cuerdas tendinosas que conectan las valvas de la válvula mitral a los músculos papilares. La sangre pasa desde el ventrículo izquierdo, a través de la válvula aórtica, hacia la aorta ascendente. Parte de la sangre de la aorta ascendente se dirige hacia las arterias coronarias, que nacen de ella e irrigan el corazón. El resto de la sangre sigue su camino a través del arco o cayado aórtico y de la aorta descendente (aorta torácica y abdominal). Las ramas del cayado aórtico y de la aorta descendente transportan la sangre hacia todo el organismo. Durante la vida fetal, un vaso temporario denominado conducto arterioso transporta sangre desde la arteria pulmonar hacia la aorta. Por lo tanto, sólo una pequeña cantidad de sangre se dirige a los pulmones fetales no funcionantes. El conducto arterioso normalmente se cierra al poco tiempo de nacer y deja una estructura remanente conocida como ligamento arterioso que conecta el arco aórtico con el tronco pulmonar. El espesor miocárdico de las cuatro cámaras varía de acuerdo con la función de cada una de ellas. Las aurículas, de paredes finas, entregan sangre a los ventrículos. Debido a que los ventrículos bombean sangre a mayores distancias, sus paredes son más gruesas. A pesar de que los ventrículos derecho e izquierdo actúan como dos bombas separadas que eyectan simultáneamente iguales volúmenes de sangre, el lado derecho tiene una carga de trabajo menor, ya que bombea sangre que recorre una corta distancia hasta los pulmones, a menor presión y contra una menor resistencia al flujo sanguíneo. Por su parte, el ventrículo izquierdo bombea sangre hacia sectores del organismo distantes, a mayor presión y contra una mayor resistencia al flujo sanguíneo. En consecuencia, el ventrículo izquierdo realiza un trabajo mucho más intenso que el derecho para mantener la misma velocidad de flujo sanguíneo. Asimismo, la forma de la luz del ventrículo izquierdo es más o menos circular, mientras que la del ventrículo derecho es semilunar. Por su parte, además de músculo cardíaco, la pared cardíaca también contiene tejido conectivo denso que Fernández, V. H. 327 forma el esqueleto fibroso del corazón. Esta estructura consiste, básicamente, en cuatro anillos de tejido conectivo denso que rodean las válvulas cardíacas fusionándolas entre sí y uniéndolas al tabique interventricular. Al mismo tiempo que forma la base estructural de las válvulas cardíacas, el esqueleto fibroso también evita el sobre estiramiento de las válvulas al pasar la sangre a través de ellas. Asimismo, sirve como punto de inserción a los haces de fibras musculares cardíacas y como aislante eléctrico entre las aurículas y los ventrículos. EL TEJIDO MUSCULAR CARDÍACO En comparación con las fibras musculares esqueléticas, las fibras musculares cardíacas son más cortas y menos circulares en sección transversa, pero tiene los mismos tipos y la misma organización de los filamentos contráctiles que el músculo esquelético. Las células cardíacas presentan ramificaciones, que les confieren la apariencia “en peldaños de escalera” característica de las fibras musculares cardíacas. Una fibra muscular cardíaca típica mide de 50 a 100 μm de longitud y tiene un diámetro de aproximadamente 14 μm. También exhiben bandas cruzadas bien teñidas, denominadas discos intercalares, que atraviesan las fibras de modo más o menos lineal. Estos discos intercalares son sitios de adhesión muy especializados entre células contiguas, que produce “fibras” de longitud variable. Por lo tanto, algunas células musculares cardíacas en una fibra pueden unirse con dos o más células a través de los discos intercalares para crear, de ese modo, una fibra ramificada. Por su parte, los componentes del disco intercalar contienen uniones célula-célula especializadas entre las células musculares cardíacas contiguas: ✓ Unión de adherencia que sostiene las células musculares cardíacas por sus extremos para formar la fibra muscular cardíaca funcional y sirve como el sitio en el que los filamentos delgados del sarcómero terminal se fijan a la membrana plasmática. ✓ Desmosomas que unen las células musculares individuales entre sí y ayudan a evitar que las células se separen ante la tensión de las contraccionesregulares repetidas, refuerzan las uniones de adherencias y se encuentran tanto en el componente transversal como en el lateral de los discos intercalares. ✓ Uniones de hendidura o de comunicación que constituyen el principal elemento estructural del componente lateral del disco intercalar. Éstos proporcionan un canal iónico de continuidad entre las células musculares cardíacas contiguas permitiendo que el estímulo eléctrico pase de una célula a otra. Este intercambio permite que las fibras musculares cardíacas se comporten como un sincitio al tiempo que retienen la integridad y la individualidad celular. Fernández, V. H. 328 El núcleo del músculo cardíaco está en el centro de la célula y las miofibrillas del músculo cardíaco se separan para rodearlo y así delimitan una región yuxtanuclear bicónica en donde se concentran los orgánulos celulares. Esta región posee mitocondrias abundantes y contiene el aparato de Golgi, gránulos del pigmento lipofuscina y glucógeno. En las aurículas cardíacas, los gránulos atriales de unos 0,3 a 0,4 mm de diámetro, también se concentran en el citoplasma yuxtanuclear y contienen las hormonas polipeptídicas denominadas péptido natriurético atrial (PNA) y péptido natriurético cerebral (PNC). Ambas hormonas son diuréticas y afectan la excreción urinaria de sodio, inhiben la secreción de renina por el riñón y la secreción de la aldosterona por la glándula suprarrenal. También son relajantes del músculo liso vascular. Asimismo, junto a cada miofibrilla, se hallan muchas mitocondrias grandes y depósitos de glucógeno. En las células musculares cardíacas, el REL se organiza en una red individual a lo largo del sarcómero, que se extiende de una línea Z a otra línea Z. Este REL no está tan bien organizado ni desarrollado como el del músculo esquelético. No separa los haces de miofilamentos en miofibrillas bien definidas y los túbulos T del músculo cardíaco penetran en los haces de miofilamentos a la altura de la línea Z, entre los extremos de la red de REL. Por consiguiente, hay un solo túbulo T por sarcómero en el músculo cardíaco. Pequeñas cisternas terminales del REL interaccionan con los túbulos T para formar una díada a la altura de la línea Z. La lámina externa se adhiere a la membrana plasmática invaginada del túbulo T al penetrar en el citoplasma de la célula muscular. Los túbulos T son más grandes y más abundantes en el músculo cardíaco ventricular que en el músculo esquelético. Sin embargo, son menos numerosos en el músculo cardíaco atrial. Inervación del corazón Aunque el corazón tiene su propio marcapasos, recibe nervios simpáticos (SNS) y parasimpáticos (SNPS) que modifican el ritmo cardiaco y la fuerza de la contracción. La estimulación simpática puede elevar el ritmo cardiaco hasta 230 lpm y la parasimpática puede reducirlo hasta 20 lpm o incluso detener el corazón durante unos segundos. La ruta simpática al corazón se origina de los segmentos cervical inferior al torácico superior de la médula espinal. Las fibras nerviosas preganglionares se extienden de ahí a los ganglios nerviosos de la cadena simpática y algunos de ellos ascienden al ganglio cervical. Las fibras postganglionares surgen en los ganglios cervicales, atraviesan un plexo cardiaco en el mediastino y continúan por los nervios cardiacos al corazón. Estas fibras terminan en los NSA Fernández, V. H. 329 y auriculoventricular (NAV) y en el miocardio auricular y ventricular, además de hacerlo en la aorta, el tronco pulmonar y las arterias coronarias. La estimulación simpática aumenta el ritmo cardiaco y la fuerza de la contracción, así como dilata las arterias coronarias para aumentar el flujo de sangre miocárdico. La ruta parasimpática empieza con los núcleos de los nervios vagos en el bulbo raquídeo y las fibras preganglionares se extienden por los nervios vagos hacia el plexo cardiaco, donde se entremezclan con las fibras simpáticas, y continúan hacia el corazón por los nervios cardiacos. Luego hacen sinapsis con las neuronas posganglionares en la superficie epicárdica y con la pared cardiaca. Las fibras posganglionares del nervio vago derecho llevan sobre todo al NSA y las del vago izquierdo conducen especialmente al NAV, pero cado uno tiene algunas fibras que cruzan a las otras células de destino. Igualmente, hay pocas inervaciones parasimpáticas en el miocardio. También llevan fibras autonómicas sensitivas (aferentes) del corazón al SNC. Estas fibras son importantes para los reflejos cardiovasculares y la transmisión de señales de dolor del corazón. PROPIEDADES CARDÍACAS Dadas las características estructurales del corazón, pueden diferenciarse tres tipos funcionales de músculo cardíaco: músculo auricular (atrial), músculo ventricular y sistema de conducción. El músculo cardiaco tiene propiedades fundamentales que pueden dividirse en dos grupos denominadas propiedades eléctricas y mecánicas: Dentro de las propiedades eléctricas se encuentran: ✓ Automatismo o cronotropismo. ✓ Excitabilidad o batmotropismo. ✓ Conductibilidad o dromotropismo. Algunos autores agregan otra propiedad, el de refractariedad. Todas ellas dependen de las características del sarcolema, tanto de los miocitos cardíacos como los del sistema de conducción. Dentro de las propiedades mecánicas se encuentran: ✓ Contractilidad o inotropismo. ✓ Relajación o lusitropismo. Fernández, V. H. 330 Estas propiedades dependen fundamentalmente de la estructura contráctil del miocardio (sarcómeras). Sin embargo, todas las propiedades dependen del metabolismo aeróbico debido al aporte de ATP necesario para la función cardíaca, con la consiguiente transferencia de iones a través de la fibra miocárdica, durante sus estados de acción, recuperación y reposo, y del ciclo excito-contráctil. AUTOMATISMO (CRONOTROPISMO) Y EL NÓDULO SENOAURICULAR El automatismo es la propiedad de producir estímulos rítmicos propios por parte del tejido cardiaco; sin embargo, esta propiedad se encuentra normalmente confinada en el nódulo senoauricular (sinusal), también llamado marcapasos y en menor medida en el sistema de conducción, especialmente en sus partes más altas, como se demuestra en los diferentes ritmos automáticos. La existencia de una actividad cardíaca eléctrica intrínseca y rítmica permite que el corazón pueda latir toda la vida, gracias a una red de fibras musculares cardíacas especializadas denominadas fibras automáticas por ser autoexcitables, las cuales generan potenciales de acción en forma repetitiva que disparan las contracciones cardíacas. Continúan estimulando el corazón para que lata, aun después de haber sido extraído del cuerpo y de que todos sus nervios hayan sido cortados. Durante el desarrollo embrionario, sólo el 1% de las fibras musculares cardíacas se diferencian en fibras automáticas actuando como marcapasos y formando el sistema de conducción para proveer un camino para que cada ciclo de excitación cardíaca avance a través del corazón y permitiendo que las cámaras cardíacas sean estimuladas para contraerse en forma coordinada, lo que hace del corazón una bomba efectiva. En condiciones normales, la excitación cardíaca comienza en el nodo senoauricular (NSA) o de Keith-Flack, localizado en la aurícula derecha, justo por debajo del orificio de desembocadura de la VCS en la cresta terminal. Tiene la forma de una coma, de 10 a 20 mm de largo y 5 mm de espesor, y está formada por tres grupos celulares diferentes. Estas comprenden a las células nodales o tipo P (del inglés “pacemaker” o marcapasos), las células transicionales o tipo T y las células musculares nodales que se mezclan con los miocitos contráctiles e incluso forman digitaciones que penetran en el miocardio normal, sin que se evidencie una cápsula fibrosa que separe ambas estructuras. El NSA esta irrigadopor la arteria del nodo sinusal, que es una rama de la arteria coronaria derecha (60%) o de la arteria circunfleja (40%) y tiene una rica inervación simpática y parasimpática. Por su parte, las células del NSA no tienen un potencial de reposo estable y, en lugar de ello, se despolarizan en forma continua y alcanzan espontáneamente el potencial umbral. Esta despolarización espontánea es un potencial marcapasos y se denomina despolarización diastólica espontánea (DDE). Cuando el potencial marcapasos alcanza el umbral, se desencadena un potencial de acción que se propaga a través de ambas aurículas, por medio de las uniones en hendidura presentes en los discos intercalares de las fibras musculares auriculares. Las fibras automáticas del NSA iniciarían por su cuenta un potencial de acción cada 0,6 segundos, o 100 veces por minuto. Así, el NSA establece el ritmo de contracción del corazón y es el marcapasos natural. Esta frecuencia es mayor que la del resto de las fibras automáticas del corazón desnervado. Fernández, V. H. 331 En condiciones de reposo, predomina la influencia parasimpática sobre el nódulo SA a través del nervio vago, lo que da lugar a una frecuencia cardíaca en reposo de alrededor de 70 a 80 lpm. En 1979, Brown, Di Francesco y Noble, describieron la corriente If (del inglés funny current) en el nódulo sinusal del conejo. La denominación “funny current” (curioso o raro) se debió a un comportamiento peculiar y distintivo de esta corriente iónica de comportamiento lento. En efecto, a diferencia de la mayoría de los canales iónicos, cuya conductancia es dependiente del voltaje y se activa con la despolarización de la membrana, el canal iónico que transporta la corriente If se activa con la hiperpolarización de la membrana. El canal iónico que utiliza la corriente If tiene la base molecular de los canales HCN. Es permeable tanto al Na + como al K+, pero en el nivel del potencial diastólico máximo (PDM) del NSA (de -60 mV a -70 mV) transporta una corriente de entrada despolarizante de Na+, que desplaza al potencial de transmembrana hacia el nivel de activación de los canales del Ca2+ tipo T (transitorios) y L (larga duración). Las características típicas de la corriente If son: fase de activación inducida por la hiperpolarización, cinética lenta de activación y desactivación, naturaleza iónica mixta de Na+ y K+, y modulación por AMPc. El voltaje de activación de la If, que es diferente en cada región, determina el rango de voltajes en el que tiene lugar la DDE en los miocitos con capacidad de marcapasos. El voltaje de activación de la If en las fibras de Purkinje es decenas de milivoltios más negativo que en el NSA. Esto explica por qué la despolarización diastólica en las células del NSA ocurre a voltajes más despolarizados (más positivos) que en las fibras de Purkinje y, por tanto, por qué el ritmo intrínseco de las células del NS es significativamente más rápido que el de las fibras de Purkinje. Incluso dentro del NSA, el rango de activación de la If de las células localizadas en la periferia es más negativo, es decir, su ritmo intrínseco es más lento, lo que refleja la organización funcional que hay en esta área. La cinética y el rango de activación de la If están modulados por varios mecanismos, entre los que destacan la presencia de subunidades auxiliares, fenómenos de fosforilación, Fernández, V. H. 332 interacción con proteínas estructurales de membrana y por el SNA a través del AMPc. La If causa el efecto cronotrópico positivo de la noradrenalina por parte del SNS a través de una desviación hacia valores más positivos de la curva de probabilidad de apertura de los canales f. Este efecto es inducido por la estimulación de receptores β1-adrenérgicos, que aumentan la actividad de la adenilatociclasa de membrana, lo que resulta en un aumento del AMPc intracelular. Como consecuencia, produce una aceleración de la pendiente y la frecuencia de la DDE. Asimismo, la corriente If también está intensamente modulada por la ACh por parte del SNPS de forma opuesta a la de las catecolaminas. La ACh inhibe la If mediante la desviación hacia valores más negativos de la curva de activación, lo que disminuye la disponibilidad de corriente durante la DDE y causa el enlentecimiento de la frecuencia cardiaca (efecto cronotrópico negativo) al estimular a los receptores muscarínicos M2 y a la proteína Gi, que inhibe la adenilatociclasa y disminuye la producción de AMPc. Característicamente, la activación de los canales f por el AMPc se produce por unión directa de esta molécula al canal, en vez de por una fosforilación mediada por el AMPc. De aquí es que estos canales forman parte de una familia de denominados “canales con compuerta de nucleótidos cíclicos activados por hiperpolarización (HCN) (hyperpolarization-activated, cyclic nucleotide-gated) y se caracterizan por estar modulados de forma doble, es decir, por voltaje y por AMPc. El potencial de acción de respuesta lenta (PARL) Como se vio previamente, las células del NSA no tienen un potencial de membrana en reposo estable. La densidad relativamente menor de los canales de K+ permeables que están abiertos de forma constitutiva, en comparación con las células de despolarización rápida del miocardio, hace que el potencial de reposo inicial de estas células sea de alrededor de -60 mV. Este potencial de membrana se reduce (se despolariza) lentamente hasta que alcanza su potencial umbral a unos -40 mV, cuando se genera de forma espontánea un potencial de acción. Esta reducción del potencial se debe a una disminución espontánea y gradual de la permeabilidad del K+, lo que disminuye la salida de K+, junto con un incremento de la entrada de Na+ a través de canales HCN. Este potencial marcapasos inestable (fase 4) significa que, si un potencial de acción no se estimula por la despolarización transmitida desde una célula adyacente, se produce un potencial de acción de forma espontánea. Las células nodales no expresan canales Nav rápidos y el ascenso del potencial de acción (fase 0) se produce por una corriente lenta de entrada de Ca2+ (ICa2+) a través de canales de Ca2+ de tipo T y tipo L. Como resultado, el ascenso del potencial de acción nodal es mucho más lento que el de las células rápidas por lo cual se lo denomina potencial de acción de respuesta lenta (PARL) y cuya duración es de unos 300 ms. Fernández, V. H. 333 El potencial umbral, relativamente menor de estas células nodales, se debe a que los canales de Ca2+ de tipo T se activan a un voltaje mayor (más positivo) que los canales de Na+ activados por voltaje. Después de la fase de ascenso, los canales de K+ se abren y la corriente de salida de K+ (IK) resultante produce la repolarización (fase 3). El potencial de acción de las células nodales carece de la fase de meseta (fase 2) que muestran las células de despolarización rápida. Dado que las células del NSA son las que presentan mayor velocidad de ascenso de la fase 4 y mayor cercanía entre dicha fase y el potencial umbral, constituyen el marcapasos normal del corazón y sólo será suplantado en situaciones patológicas por el menor automatismo de otras zonas específicas subsidiarias, dado que la característica distintiva del automatismo normal es la “supresión por sobreestimulación”. Esto es así porque la sobreestimulación de una célula marcapasos a una frecuencia más rápida, que su frecuencia intrínseca, origina una disminución de la pendiente de la fase 4 generada por la sobreactivación de la bomba de Na+/K+-ATPasa. Una vez finalizada la sobreestimulación, se produce un retorno gradual (lento) a la frecuencia de descarga intrínseca, que se denomina “periodo de calentamiento”. El grado de supresión y el tiempo de recuperación son proporcionales a la frecuencia y la duraciónde la sobreestimulación aplicada. Si por algún motivo el NSA dejara de funcionar, la UAV generaría una descarga con cadencia normal de 40 a 60 lpm y si éste también fallara, la red subendocárdica de Purkinje, con cadencia de 25 a 40 lpm tomaría el mando. Excepcionalmente, las células del tejido miocárdico contráctil presentan despolarización automática, no provocada por un estímulo, lo que se conoce como automatismo anormal. Se postula que el automatismo anormal puede aparecer en los casos de hiperpotasemia, pH intracelular bajo y exceso de catecolaminas. EXCITABILIDA (BATMOTROPISMO) El potencial de acción de respuesta rápida Todas las células cardíacas son excitables, es decir, son capaces de responder a estímulos externos (químicos, mecánicos, térmicos o eléctricos) generando una respuesta eléctrica, el potencial de acción cardíaco, a la que va acoplada la correspondiente respuesta contráctil. Sin embargo, no todos los estímulos fisiológicos o experimentales tienen igual capacidad para generar un potencial de acción, siendo necesario una mínima intensidad umbral de excitabilidad, cuyo valor varía en los distintos tejidos cardíacos y en un mismo tejido, dependiendo de la frecuencia de estimulación o de la concentración de neurotransmisores, hormonas, fármacos o de iones. Si bien se explican a las distintas propiedades como separadas, todas están relacionadas directamente y en conjunto trabajan para llevar a cabo la importante función de generar el estímulo, conducirlo por todo el corazón y generar la contracción para impulsar la sangre por todo el cuerpo. Por ello, la excitabilidad comienza con el automatismo del NAV y continúa por todo Fernández, V. H. 334 el corazón de manera organizada. Sin embargo, el potencial que se genera en el corazón, a diferencia del NSA y UAV, es diferente dado que corresponde a un potencial de acción de respuesta rápida (PARR), la cual depende de la fase 0 y no de la duración del potencial de acción (DPA). Los potenciales de acción en las células que se despolarizan rápidamente constan de cinco fases y se originan por un potencial de acción de una célula adyacente dando lugar a un PARR que dura aproximadamente unos 300 ms. La forma del potencial de acción no es uniforme en los miocitos de trabajo de las distintas regiones del corazón, y la velocidad de conducción de los potenciales de acción también varía: ✓ Fase 0: despolarización rápida (ascenso). Cuando la membrana se despolariza al alcanzar el potencial umbral (entre -60 y -65 mV), los Nav se abren, lo que permite la entrada rápida de Na+ a favor de su gradiente electroquímico (INa). Esto desplaza el potencial de membrana hacia el potencial de equilibrio del Na+ (+65 mV) y provoca la despolarización. La rapidez de esta despolarización se debe a un efecto de retroalimentación positiva en el que la despolarización produce la apertura de más Nav, lo que provoca una mayor despolarización. Recordemos que los Nav del miocardio funcionan exactamente igual que los del músculo esquelético y o los de las fibras nerviosas. ✓ Fase 1: intento de repolarización. A medida que el potencial de membrana alcanza un valor de unos +20 mV, los Nav se inactivan de modo que finaliza la corriente de entrada rápida de Na+. Mientras, la corriente de fondo de salida persistente de K+ provoca una ligera repolarización mediante la apertura de canales transitorios de potasio (ITO transient outward). La fase 1 es más marcada en las fibras de Purkinje. ✓ Fase 2: se produce una fase de meseta que está mediada por la apertura de canales de Ca2+ de tipo L, que son canales de Ca2+ activados por voltaje cuya activación se produce lentamente después de que el potencial de membrana supere aproximadamente los -35 mV (durante la fase 0). La corriente lenta de entrada de Ca2+ (ICa) se equilibra por la salida de K+, por lo que el potencial de membrana permanece relativamente estable. Hacia el final de la fase 2, a medida que los canales de Ca2+ se cierran, el potencial de equilibrio se mantiene por una corriente de entrada producida por la acción del intercambiador 3Na+/Ca2+. La presencia de esta fase de meseta es una diferencia clave entre el potencial de acción cardíaco y el de las neuronas. Evita una repolarización rápida y la corriente sostenida de Ca2+ es fundamental para permitir que se produzca la contracción. Mientras que los potenciales de acción neuronales duran unos 2 ms, la meseta prolonga el potencial de acción cardíaco unos 200 ms. ✓ Fase 3: una vez que termina la corriente de entrada de Ca2+, se abren más canales de K+ (incluidos los activados por voltaje y los activados por ATP), lo que aumenta la salida de K+ por canales rectificadores lentos (IK). Esto produce la repolarización de la membrana hasta su potencial de reposo. Un retraso o un defecto de la apertura de estos canales de K+ debido a un defecto genético retrasa a su vez la repolarización y se manifiesta como un síndrome de QT largo. ✓ Fase 4: cuando la repolarización se completa, el potencial de membrana vuelve a su valor de reposo y el ciclo se repite cuando se produce la estimulación por una célula adyacente. El Na+ que entró durante la fase 0 es removido por la bomba de Na+/K+ ATPasa y el Ca2+ que ingresó en la fase 2 es removido por el intercambiador 3Na+/Ca2+. El calcio también es eliminado por la bomba de Ca2+-ATPasa, que lo extruye fuera de la célula en parte y también lo acumula en el retículo sarcoplásmico. Fernández, V. H. 335 REFRACTARIEDAD CARDÍACA Durante un potencial de acción, las células cardíacas son refractarias a la excitación, es decir, no se puede generar otro potencial de acción. Existen dos períodos refractarios diferentes: ✓ Período refractario absoluto (PRA), durante el cual no se puede desencadenar otro potencial de acción, con independencia de lo intenso que sea el estímulo. Comienza al principio de la fase 0 y dura hasta que la membrana se ha repolarizado a unos -50 mV. Este período refractario es crucial puesto que impide que se inicie un nuevo potencial de acción durante el previo, lo que deja el tiempo suficiente para el llenado ventricular antes de la siguiente contracción. Dado que en los miocitos ventriculares de un corazón sano el PRA es de unos 250 ms, la máxima frecuencia a la que puede latir el corazón de forma coordinada es de 240 latidos por minuto (lpm) aproximadamente. ✓ Período refractario relativo (PRR), es aquel durante el cual se puede iniciar un potencial de acción sólo con estímulos intensos. Cuando el potencial de acción baja de - 50 mV, algunos de los Nav se reinician (vuelven a su reposo) y están preparados para volver a activarse; sin embargo, sólo unos pocos están preparados, por lo que se requiere un estímulo intenso. En los miocitos de trabajo, dura hasta que se alcanza el potencial de membrana en reposo y puede durar hasta la fase 4 en las células nodales. En los NSA y UAV el período refractario excede la duración del potencial de acción, por lo que no es posible generar un nuevo potencial de acción propagado hasta incluso después de que la célula se ha repolarizado por completo. Este fenómeno, denominado refractariedad post- repolarización, es debido a que los canales de Ca2+ tardan 100 a 300 ms en reactivarse. El hecho de que el NAV presente un período refractario prolongado, representa un mecanismo protector que, en presencia de ritmos supraventriculares rápidos, impide que aparezcan aumentos muy marcados de la frecuencia ventricular y que podrían poner en peligro la función de la bomba ventricular. Por su parte, el PRA de las fibras rápidas dependen del voltaje, dado que el funcionamiento de los Nav es igual al que se presenta en los otros tejidos excitables requiriéndose un potencial más negativo para que el ciclo de activación-inactivación de suscompuertas sea la óptima; es decir, necesita un voltaje cercano a su reposo de -90 mV para que se puedan activar nuevamente los Nav. Fernández, V. H. 336 EL SISTEMA DE CONDUCCIÓN Y LA CONDUCTIBILIDAD (DROMOTROPISMO) El latido es coordinado por un sistema de conducción cardiaco formado por tejido miocárdico especializado en la generación y la transmisión del impulso cardiaco; sus células con escasas miofibrillas, se conectan por sus discos intercalares con uniones de hendidura de baja impedancia eléctrica, lo cual permite transmitir el impulso cardiaco; por ello, la velocidad de conducción es seis veces más rápida en sentido longitudinal. Es importante recalcar que esta propiedad es posible gracias a las características estructurales del miocardio que constituyen un sincitio (del griego “syn”, junto y “kytos”, caja, célula) funcional. Además, las membranas celulares que conectan a las células miocárdicas tienen una alta permeabilidad a los iones. Esta permeabilidad, junto con la disposición en paralelo, hace posible que la transmisión del impulso electroquímico y contráctil sea lineal y unidireccional. El sistema de conducción está formado por: 1. El NSA, marcapasos que inicia cada latido y determina el ritmo cardiaco. 2. Haces internodales que son vías preferenciales de conducción intraauricular y están formadas por células nodales tipo T y miocardio auricular, tienen mayor velocidad de conducción y despolarización, y potenciales de acción más prolongados. Estos haces comprenden al haz posterior de Thorel que transcurre en cercanías de la cresta terminal; el haz medio de Wenckebach de trayecto variable, y el haz anterior de Bachman que se dirige desde el borde anterior del NSA hacia el tabique interauricular, dividiéndose en dos fascículos, uno que va a la aurícula izquierda y el otro que discurre por el tabique interauricular hacia la unión AV. Todos estos haces se anastomosan entre sí por encima de la porción compacta del NAV. La conducción es más rápida por los haces de Bachman y Thorel; en este proceso, primero se activa la aurícula derecha, luego el septum interauricular y finalmente la aurícula izquierda. El tiempo de conducción internodal es de 0,03 segundos y la velocidad de conducción de 1 m/s. 3. El nódulo auriculoventricular (NAV) o nodo de Aschoff-Tawara que, aunque fue descripta como un nódulo, es un área de bordes no definidos, localizada por encima del anillo tricuspídeo, en el lado derecho del septum interauricular y delante del ostium del seno coronario, por lo cual se denomina unión auriculoventricular (UAV), la cual tiene tres zonas: a) Zona de células transicionales que está formada por miocardio auricular, haces internodales y las interconexiones entre estos y la porción compacta de la UAV, en esta zona están la vía rápida anterosuperior de unos 2 mm que corre por el tabique interauricular cerca del tendón de Todaro y la vía lenta posteroinferior de 4 mm que viene desde el piso del ostium del seno coronario a lo largo del anillo tricuspídeo. b) Porción compacta de la UAV que es la continuación de las vías rápida y lenta de la UAV, de 3 x 4 x 6 mm, localizada en el subendocardio del septum interauricular, por encima del implante de la valva septal de la tricúspide, delante del ostium del seno coronario, en el vértice del triángulo de Koch. c) Porción penetrante de la UAV que se continúa con el haz de His cuando atraviesa el cuerpo fibroso central a nivel de la inserción del tendón de Todaro. La UAV actúa como una compuerta eléctrica hacia los ventrículos, mientras que el esqueleto fibroso actúa como un aislante que evita que las corrientes lleguen a los ventrículos por cualquier otra ruta. Aquí, el estímulo cardiaco experimenta un retardo fisiológico de 0,05 a 0,10 segundo lo cual permite un mayor llenado ventricular antes de su sístole. La velocidad de conducción en la UAV es de 0,2 m/s y en la porción compacta 0,05 m/s, porque sus células tienen potenciales de reposo más negativos y pocas uniones de hendiduras entre ellas, por lo que hay una elevada resistencia a la Fernández, V. H. 337 conducción iónica. Solo bajo circunstancias patológicas, la UAV puede ser el marcapasos cardiaco. 4. El haz de His (HH) es la ruta por la cual las señales dejan la UAV, de unos 20 x 2 mm, inicialmente discurre por el borde inferior de la porción membranosa del tabique interventricular y a su salida se divide en ramas derecha e izquierda. La rama derecha es fina y larga (1,5 x 50 mm y continúa la dirección del haz), transcurre por la cara derecha y debajo del endocardio del tabique interventricular, hasta la base del músculo papilar medial derecho y el ápex, donde se ramifica. La rama izquierda es gruesa y corta (4 x 15 mm), dando las primeras fibras para el fascículo posteroinferior izquierdo, luego para el fascículo anterosuperior izquierdo, que se dirigen a la base de los músculos papilares posterior y anterior respectivamente. Una tercera rama medioseptal discurre por la cara izquierda del tabique interventricular. El HH y sus ramas están envueltas en una vaina que las aísla del miocardio vecino, sus células son largas, vacuoladas, con mitocondrias ordenadas y pocas miofibrillas. El estímulo es conducido rápidamente por la presencia de uniones de hendiduras de alta permeabilidad para los iones. La rama derecha es más larga y más delgada que la izquierda, lo que la hace más susceptible al daño. La velocidad de conducción en el HH es de 1 a 1,5 m/s. 5. El sistema de Purkinje es la porción terminal del sistema de conducción, constituida por células grandes, vacuoladas, con pocas miofibrillas y mitocondrias de aspecto desordenado, forma una fina red de fibras interconectadas entre sí por conexiones latero- laterales y término-terminales mediante discos intercalares que favorecen una conducción longitudinal rápida. La red de Purkinje es más abundante en las bases de los músculos papilares y además tienen una mayor resistencia a la isquemia. Los ventrículos son activados simultáneamente de endocardio a epicardio, el derecho toma menos tiempo debido a su menor masa muscular. La velocidad de conducción es de 3 a 5 m/s y en el miocardio ventricular 1 a 2 m/s. Una vez que las fibras de Purkinje han llevado la señal eléctrica a sus límites, los miocardiocitos la mantienen al pasar iones de una célula a la otra a través de sus uniones intercelulares comunicantes. Fernández, V. H. 338 Alteraciones del automatismo El automatismo normal puede alterarse por “exceso” o “defecto” de automatismo del NSA, por focos ectópicos o postpotenciales. Un foco ectópico consiste en un grupo de células del tejido específico (excepcionalmente del tejido de trabajo) que desarrollan un automatismo superior al del NSA, desplazándole como marcapasos del corazón y funcionando como nuevo marcapasos de la actividad cardíaca. El foco ectópico puede ser único o múltiple y, en ambos casos, es posible que intervenga de forma aislada, generando un único impulso, o persistentemente durante un período de tiempo más o menos prolongado, emitiendo impulsos sucesivos. Por su parte, el postpotencial es una modalidad de automatismo excesivo menos habitual que el foco ectópico. Se los denomina de este modo porque siempre van precedidos de un potencial de acción. Consisten en despolarizaciones espontáneas que surgen antes de que se complete la fase de repolarización y que, al alcanzar el potencial umbral, generan un nuevo potencial de acción. Se presentan al inicio de la repolarización (Pospotenciales precoces) o al final de la misma (Pospotenciales tardíos). Conducción auriculoventricular alterada Las alteraciones de la conducción incluyen el enlentecimiento o aceleración de la conducción de los impulsos, y un fenómeno de características peculiares conocido como reentrada o reingreso. El enlentecimientode la conducción se produce por una reducción de la velocidad de ascenso de la fase 0 del potencial de acción transmembrana, hasta llegar a un límite en el que se interrumpe totalmente la propagación de los impulsos en alguna región del tejido específico (bloqueos). Por su parte, naturalmente existe una sola vía de conducción entre las aurículas y los ventrículos a través de la UAV. Sin embargo, algunas personas tienen una conexión adicional Frecuencia de disparo y velocidad de conducción en las diversas estructuras cardíacas Frecuencia (lpm) Velocidad de conducción (m/s) NSA 60 a 100 0,05 Tractos internodales 15 a 25 1 Fibras auriculares 0 0,3 a 1 UAV 40 a 60 0,05 a 0,2 Haz de His 1 a 2 Sistema de Purkinje 20 a 40 3 a 5 Fibras ventriculares 0 0,5 a 1 Fernández, V. H. 339 anormalmente rápida que da lugar al llamado síndrome de Wolff -Parkinson-White, mediante el haz de Kent entre las aurículas y los ventrículos. Esto torna la conducción más rápida en comparación con la UAV de conducción lenta y un ventrículo se excita de manera prematura. La taquicardia auricular paroxística observada en este síndrome a menudo sigue a un latido auricular prematuro, que se conduce de manera normal por la UAV, pero se propaga al extremo ventricular del haz alterado y el impulso se transmite de regreso a la aurícula. Así se establece un movimiento en círculo. Con menor frecuencia, un latido auricular prematuro encuentra a la UAV en periodo refractario, pero llega a los ventrículos a través del haz de Kent, lo cual establece un movimiento en círculo en el que el impulso pasa de los ventrículos a las aurículas por la UAV. Por su parte, en el síndrome de Lown-Ganong-Levine, existe una taquiarritmia supraventriculares de diverso tipo (taquicardias regulares, aleteo auricular y fibrilación auricular). Su sustrato anatómico puede estar dado por una conducción nodal acelerada, conexiones aurículo-hisianas que, cuando se insertan en el His distal, determinan además la existencia de un intervalo His-Ventrículo (H-V) corto y fibras de James o tractos internodales posteriores. Las vías nodoventriculares y fasciculoventriculares, conocidas como fibras de Mahaim que se localizan en el lado derecho del corazón y constituyen variantes de preexcitación. Las taquicardias de Mahaim son antidrómicas, ello significa, que el ventrículo es despolarizado por vía de la conexión anómala y el circuito de la taquicardia se completa al regresar el impulso por la UAV a la aurícula y de allí al ventrículo por la conexión anómala; en consecuencia. Un fenómeno muy interesante y complejo es el “fenómeno de la reentrada”. Para comprenderlo se puede tomar como sustrato anatómico del mismo dos ramas terminales de la red subendocárdica de Purkinje. Si en condiciones patológicas se produce la coincidencia de una conducción lenta a través de la rama 1 y un bloqueo de la conducción en la rama 2, por hallarse sus células en período refractario, el impulso eléctrico que llega sólo puede ser conducido a través de la primera. Sin embargo, como la rama 1 conduce lentamente, cuando el impulso llega por vía retrógrada a la rama 2, ésta ya ha recuperado su excitabilidad y puede acceder otra vez a la rama 1, provocando así una nueva y prematura despolarización del miocardio. Por tanto, las condiciones electrofisiológicas que promueven la reentrada incluyen: a) Un circuito con dos vías de conducción del impulso. b) Conducción lenta en una de ellas. c) Bloqueo unidireccional de la conducción en la otra. El foco de reentrada puede tener una localización única o múltiple, pudiendo suceder que la reentrada se instaure de forma aislada, con lo que origina un único impulso, o bien de manera persistente durante un período de tiempo más o menos prolongado, generando impulsos sucesivos. La UAV es una ubicación preferente del fenómeno, ya que, al estar formado por dos vías, una con conducción rápida y otra lenta, se establece la reentrada en cuanto la vía rápida se bloquea. La reentrada puede seguir también un trayecto extenso (macrorreentrada), como ocurre cuando un impulso que alcanza el ventrículo por la vía normal auriculoventricular Fernández, V. H. 340 reingresa en la aurícula a través de la vía accesoria anómala que comunica el miocardio ventricular y el auricular (como se vio anteriormente). Consecuencias de las alteraciones en el automatismo y la conducción eléctrica Todas las alteraciones anteriores, entre otras, desencadenan variaciones del ritmo cardíaco denominados en conjunto “arritmias” que se evalúan mediante el electrocardiograma (ECG). Estas pueden ser bradiarritmias (arritmias lentas) y taquiarritmias (arritmias rápidas) La presencia de una arritmia sostenida puede presentar algunas de las siguientes alteraciones: ✓ Bradicardia extrema, con disminución del gasto cardíaco y de la perfusión cerebral. ✓ Taquicardia que, al disminuir el tiempo diastólico, limita el llene ventricular y el gasto cardíaco. ✓ Taquicardia que aumenta el consumo de O2 miocárdico lo que puede desencadenar angina y en el largo plazo deterioro de la función ventricular. ✓ Pérdida de la activación secuencial aurículo-ventricular, con aparición o agravamiento de una insuficiencia cardiaca. PROPIEDADES MECÁNICAS La contracción del miocardio es iniciada por el potencial de acción que actúa sobre organelos intracelulares para evocar generación de tensión, acortamiento o ambos. LA CONTRACTILIDAD (INOTROPISMO) Acoplamiento excitación-contracción El acoplamiento excitación-contracción es el proceso que acopla el potencial de acción con la contracción del músculo cardíaco, un proceso que depende del aumento de la concentración de Ca2+ citosólica. La excitación eléctrica se extiende hacia el interior de la célula por los túbulos T, que se invaginan hacia el interior de las fibras cardíacas en las líneas Z. Las células cardíacas contienen una amplia red de túbulos T que se extienden longitudinalmente a lo largo de las fibras miocárdicas (a diferencia de la disposición radial que se observa en el músculo esquelético). Éstos llevan los potenciales de acción a la profundidad de la célula, donde abren canales de calcio dihidropiridina (DHP) que están acoplados a los canales liberadores de calcio sensibles a la rianodina en el RS. Durante la fase 2 del potencial de acción cardíaco el Ca2+ entra en el citosol a través de canales de Ca2+ de tipo L y estimula a una mayor liberación de Ca2+ a partir del RS en el proceso ya conocido como “liberación de Ca2+ inducida por Ca2+”, dado que la cantidad de Ca2+ que penetra en la célula desde el líquido intersticial extracelular no es suficiente para inducir la contracción de las miofibrillas. Se estima que alrededor del 40 al 50% del incremento del Ca2+ citosólico procede del espacio extracelular y el resto del RS, incrementándose desde menos de 0,1 μmol/l, hasta una cifra tan alta como 100 μmol/l. se estima que el 10% del Ca2+ extracelular se utiliza directamente para la contracción mientras que el resto estimula la salida de Ca2+ del RS. En el músculo cardíaco, el canal de DHP está ligado al RyR en la membrana del RS, de forma que cada determinada cantidad de calcio que pasa a través del canal de DHP causa una liberación pequeña y localizada de calcio desde un RyR en el RS. Estas ráfagas de calcio localizadas e intracelulares se denominan chispas de calcio. La elevada concentración Fernández, V. H. 341 localizada causada por una sola chispa de calcio no difunde a una concentración lo suficientemente elevada por el líquido intracelular hasta los receptores vecinos en el RS como para que se abran. En lugar de eso, en el interior de la célula miocárdica se suman temporal y espacialmente múltiples chispas de calcio para producir aumentos globales de la concentraciónintracelular de Ca2+. Además, las altas concentraciones intracelulares de calcio estimulan el bombeo de Ca2+ al interior del RS por la Ca2+- ATPasa, lo que crea una gran acumulación de calcio dentro del RS que puede liberarse con la siguiente apertura de los canales de liberación de calcio del RS. El Ca2+ que abandona el RS a través de los RyR, se liga después a la TnC y se desbloquean los sitios activos entre los filamentos de actina y miosina. Este desbloqueo inicia el ciclo de enlaces cruzados y la contracción de las miofibrillas ya que los mecanismos son básicamente los mismos que en el músculo esquelético. Por su parte, existen mecanismos que incrementan la [Ca2+] citosólico y, por ende, aumentan la fuerza generada; mientras que los que la reducen, disminuyen la fuerza generada. Por ejemplo, los β-adrenérgicos aumentan la entrada de Ca2+ en la célula por fosforilación de los canales del Ca2+ activados por voltaje (o potencial) del sarcolema (POC) a través de una proteincinasa dependiente del AMPc. Esta fosforilación aumenta la probabilidad de que se abra el canal y también el tiempo promedio durante el cual el canal permanece abierto una vez activado. Esto, a su vez, libera más Ca2+ del RS y, en consecuencia, la fuerza contráctil aumenta. El aumento de la [Ca2+] extracelular incrementará la cantidad de Ca 2+ que entra a la célula a través de los canales del Ca2+ y ello aumentará la fuerza contráctil. Asimismo, los mecanismos activados por el AMPc aceleran la relajación durante los incrementos de la contractilidad celular debidos al receptor β-adrenérgico, fosforilando la troponina I y disminuyendo su afinidad por el Ca2+, además de fosforilar al fosfolamban de la bomba de Ca2+ del RS lo cual acelera su recaptación. Dado que la concentración de Ca2+ cambia durante cada potencial de acción, los aumentos de la frecuencia cardiaca, con un mayor número de potenciales de acción por minuto, pueden incrementar la disponibilidad de Ca2+ para la contracción, lo que aumenta la cantidad de tensión que puede generarse. Este fenómeno se llama fenómeno de escalera o Treppe. Una vez en el citosol, los iones Ca2+ se unen a la TnC, lo que modifica la posición de la tropomiosina y expone las cabezas de miosina, de modo que pueden unirse a los filamentos de actina, lo que permite que se produzca la contracción. Cuanto mayor es la concentración de Ca2+ citosólica, mayor es el número de puentes cruzados actina-miosina que se forman, y más fuerte es la contracción. Por tanto, la cantidad de entrada Fernández, V. H. 342 de Ca2+ y el grado de incremento de su concentración citosólica determinan la contractilidad del miocardio. La contractilidad (inotropismo) se define como la fuerza generada por el músculo cardíaco para una longitud determinada de la fibra. Los factores que influyen en la contractilidad se denominan factores inotrópicos y tienen un efecto positivo o negativo. La duración de la contracción de la célula de músculo cardiaco es aproximadamente la misma que la de su potencial de acción, por consiguiente, el periodo refractario eléctrico de una célula de músculo cardiaco no termina sino hasta que se completa la respuesta mecánica. La relajación mecánica acompaña la repolarización eléctrica, como consecuencia, las células de músculo cardiaco no pueden ser activadas con suficiente rapidez para causar un estado de tetanización con una contracción prolongada, esto es conveniente porque la contracción y relajación coordinadas son esenciales para la acción de bombeo del corazón. Mecánica de la célula de músculo cardiaco La interacción de puentes cruzados, que ocurre luego de la activación muscular por el potencial de acción, permite el desarrollo de fuerza contráctil, el acortamiento o ambos, de las fibras miocárdicas. El hecho de si hace una, la otra o alguna combinación de ambas, depende principalmente de lo que es permitido que suceda por las influencias externas impuestas sobre el músculo durante la contracción. Justamente, las células musculares en la pared ventricular operan bajo diferentes restricciones durante distintas fases de cada ciclo cardiaco, y pasan por contracciones tanto isométrica como isotónica. Este acortamiento es el que al posibilita la reducción de las cavidades cardiacas, de tal modo que se produce la eyección de sangre de aurículas y ventrículos. Como propiedad intrínseca de la miofibrilla, la contractilidad es sólo una parte de varios factores cuyo resultado es el gasto cardiaco. Como el miocardio es músculo estriado, comparte en buena medida la estructura y mecanismos de contracción con el músculo esquelético. Sin embargo, existen diferencias muy importantes a destacar. El aparato contráctil está integrado con tres estructuras principales: un disco central (línea M) que tiene a cada lado filamentos de miosina unidos de forma perpendicular y extendidos en sentido lateral desde la línea M hasta los otros dos discos (líneas Z), uno de cada lado, pero sin establecer contacto con ella. En cada línea Z, a su vez, están dispuestos también de forma perpendicular filamentos de actina que se extienden hacia la línea M, sin llegar a ella. El proceso de contracción tiene la función de que los filamentos de miosina “acerquen” la línea M a cada una de las líneas Z, de manera tal que la longitud del sarcómero disminuye. La contracción sincronizada y simultánea de cada uno de los sarcómeros en una fibra muscular es lo que origina el acortamiento (contracción) del músculo. Fernández, V. H. 343 En el extremo de cada molécula de miosina se localiza una cabeza que interactúa con la actina para el proceso de contracción, una vez que ha sido energizada por la hidrólisis del ATP. No obstante, en condiciones basales, los sitios de unión de la actina con la miosina están bloqueados por la tropomiosina que se halla en íntima relación con la actina que, a su vez, posee al complejo troponina (TnI, TnC y TnT). Una vez que se produce el aumento de Ca2+ citosólico, se produce la liberación de los sitios activos de la actina para que las cabezas de la miosina interactúen formando los puentes cruzados (cross-bridging). La flexión de las cabezas de miosina unidas a la actina provoca el “arrastre” de la estructura de actina hacia el centro del sarcómero (línea M). La separación del puente se produce por la entrada de otra molécula de ATP y se produce un nuevo puente cruzado siempre y cuando haya Ca2+. Este ciclo no se produce de forma sincrónica en todas las uniones actina-miosina. Sin embargo, la contracción muscular es posible debido a que, en el estado de alto flujo de Ca2+, la mayor parte de las uniones se sincroniza para que predomine el estado de flexión en las cabezas de miosina. El proceso contráctil se manifiesta en las fibras miocárdicas como un ciclo de contracción y relajación (elongación) de manera sincronizada en todas las fibras miocárdicas dispuestas en diferente orientación espacial y, debido a la configuración de la “banda miocárdica”, se logra el proceso global de la contracción, principalmente del ventricular. Fernández, V. H. 344 Macroscópicamente, gracias a los estudios realizados por Torrent-Guasp, se ha hecho posible caracterizar el proceso de contracción y relajación miocárdica, según el cual “el miocardio ventricular configura una banda extendida desde la raíz de la arteria pulmonar hasta la raíz de la aorta que delimita, describiendo en el espacio una helicoide y dos cavidades que constituyen a los ventrículos”. La banda miocárdica describe dos vueltas de espiral que constituyen el helicoide y así pueden identificarse dos lazadas, ambas con dos segmentos: la lazada basal (con los segmentos derecho e izquierdo) y la lazada apexiana (con los segmentos ascendente y descendente). La contracción secuencial de los distintos segmentos da origena diferentes efectos en la mecánica ventricular, según sea su disposición en la hélice de la banda cardiaca. El mecanismo anterior permite comprender la contracción y la relajación miocárdica. Sin embargo, es muy importante comprender que la valoración de la contractilidad, permite conocer la salud del miocardio en su función como bomba, pero esta no depende solo de la propiedad intrínseca e independiente que es la contractilidad, sino de la interacción que tiene ésta con otras condicionantes del gasto cardiaco, entre ellas la precarga, la poscarga y la frecuencia cardiaca. En principio, son cuatro los factores que influyen en la fuerza contráctil del músculo cardíaco: 1. La precarga. 2. La poscarga. 3. El estado inotrópico. 4. La frecuencia cardíaca. Efecto de la precarga y la ley de Frank-Starling (regulación heterométrica) La precarga es el volumen al final del llenado ventricular o de la diástole (volumen telediastólico) y puede considerarse que es la longitud telediastólica de la fibra miocárdica (longitud en reposo) desde la cual se contrae el miocardio. La relación entre la precarga y la tensión o la presión generada depende del grado de solapamiento de los miofilamentos. El corazón muestra una relación longitud-tensión similar a la del músculo esquelético, que relaciona la generación de fuerzas isométricas con la distensión inicial o precarga del músculo. Sin embargo, el músculo cardíaco no está adherido a un punto fijo como sucede con el músculo esquelético. Además, el corazón es un órgano hueco y distensible, pero es intrínsecamente más rígido que el esquelético y opone una importante resistencia pasiva a la distensión hasta una longitud correspondiente a la longitud óptima (Lo), llevando al miocardio a tener que contraerse a partir de longitudes menores a Lo. Esto implica que el corazón deba generar una fuerza o tensión proporcional a su precarga, o su distensión pasiva inicial, antes del comienzo de la contracción. En el corazón, la distensión pasiva o precarga es proporcional a la magnitud del llenado del corazón durante la diástole, por lo Fernández, V. H. 345 cual, un mayor llenado aumenta la posible fuerza contráctil isométrica que puede generarse en el corazón. En 1918, Ernest Starling estableció que cuando más se estira el músculo mayor será la fuerza contráctil dentro de límites fisiológicos, ya que el corazón impulsará toda la sangre que le llega sin permitir un remanso excesivo en las venas. Esto muestra la capacidad intrínseca del corazón para adaptarse a las cargas variables de sangre que le llega. Dado que Otto Frank en 1895 había llegado a conclusiones similares, este mecanismo se conoce como ley de Frank-Starling o de autorregulación heterométrica. Efecto de la poscarga sobre la contractilidad La poscarga se define como la fuerza o presión que el miocardio debe generar para acortarse contra todas las fuerzas que se oponen a la eyección de sangre. Esto significa que la poscarga pone límite a la fuerza miocárdica que debe generar una presión intraventricular suficiente para abrir la válvula aórtica y permitir así la eyección del contenido ventricular. Fundamentalmente, la poscarga está determinada por la tensión parietal o el estrés (fuerza ejercida sobre un área que describe la fuerza dirigida alrededor de la circunferencia del ventrículo) que soporta la pared ventricular durante la fase de eyección y depende de la geometría de la cavidad ventricular y el valor de la presión diastólica final en la aorta que, a su vez, va a depender de la distensibilidad de los vasos y de la resistencia periférica vascular que se opone al movimiento de la sangre. La tensión parietal depende de las características anatómicas del ventrículo, dado que las células miocárdicas están orientadas de manera circunferencial en la pared ventricular. Al respecto, puede considerarse que: 1. Un aumento del volumen ventricular de llenado causa un incremento de la circunferencia ventricular y, por ende, un aumento de la longitud de las células de músculo cardiaco individuales. Así, la magnitud de llenado diastólico del ventrículo determina la “precarga”. 2. A cualquier volumen ventricular dado, un incremento de la tensión de células de músculo cardiaco individuales en la pared causa un aumento de la presión intraventricular. 3. A medida que el volumen ventricular disminuye (se reduce el radio ventricular), las células musculares en las paredes ventriculares requieren una menor fuerza total (colectiva) para producir cualquier presión intraventricular dada. Este punto es un reflejo de la ley de Laplace, que establece que “la tensión de pared total (T) depende, tanto de la presión intraventricular (P), como de su radio interno (r)”. T = P × r. En términos físicos, si se considera la curva longitud-tensión, la zona dentro del área comprendida por la vía del músculo cardíaco que se ilustra en la figura, representa el trabajo realizado por el músculo sobre la carga externa. Si se cambia la poscarga o la longitud inicial (o ambos), se trazará una vía diferente. La zona acotada variará con los cambios en las condiciones de la contracción, reflejando diferentes cantidades de trabajo externo proporcionado a la carga. Una implicación de la ley de Laplace es que las células musculares en la pared ventricular tienen un trabajo un poco más fácil de producir presión interna al final de la sístole (cuando el radio es pequeño) que al principio de la sístole (cuando el radio es grande). Esto es importante debido a que el consumo de energía que realiza el corazón en cada ciclo cardiaco lo transforma en trabajo útil o trabajo externo (TE) y en calor o trabajo interno (TI). Fernández, V. H. 346 En el TE se consume el 20% de la energía total, mientras que en el TI se consume el 80% restante. El TI o trabajo potencial se produce como consecuencia de los eventos cardiacos que llevan al músculo ventricular a la contracción isovolumétrica (no se convierte en trabajo mecánico), y en el cual ocurren movimiento de iones, estiramiento en serie, fuerzas viscosas, formación de puentes, reorganización de la estructura muscular durante la contracción, entre otros, todos ellos consumen energía y se genera tensión que no determina expulsión de sangre, por lo cual se produce calor. Asimismo, como este trabajo se hace para vencer la poscarga (presión arterial diastólica) su intensidad depende de ésta (si la poscarga está aumentada, también aumenta el TI). A este TI también se le llama trabajo en presión por ser la energía consumida para generar la presión sistólica. El TE se refiere al trabajo realizado durante la eyección de sangre en la sístole ventricular (trabajo sistólico) y es igual a la suma del trabajo presión volumen (Tpv) y el trabajo cinético o de aceleración (Ta). También se lo conoce como trabajo en volumen, porque se produce para cambiar el volumen. TE = Tpv + Ta El Tpv viene determinado por el producto de la presión sistólica media (aproximadamente la presión arterial media o PAM) por el volumen de eyección o volumen sistólico. Tpv = PAM x VS El corazón en contracción imprime una aceleración a la masa de sangre inerte en el ventrículo y, por tanto, una energía cinética que se suma al trabajo presión volumen. Este trabajo es el trabajo de aceleración (Ta = energía cinética = ½mv2, donde “m” es la masa sanguínea por latido y “v” es la velocidad de la sangre en ese latido). Efecto del estado inotrópico del miocardio El efecto de cualquier condición de carga sobre la fuerza contráctil generada por el corazón puede verse alterada por el estado inotrópico de éste. Para una determinada precarga, la generación de fuerza isométrica del músculo cardíaco aumenta debido a estímulos inotrópicos positivos y disminuye por los negativos. Fernández, V. H. 347La pendiente de la línea ascendente en las curvas de la siguiente figura es proporcional al estado inotrópico, de modo que estas influencias positivas aumentan la fuerza isométrica para cualquier precarga a lo largo de la línea ascendente. Por ello, en el músculo cardíaco, los cambios en la precarga ejercen un efecto sobre la relación fuerza isotónica-velocidad, que es similar al que se observa en el músculo esquelético. Al disminuir la precarga, se reduce la velocidad de acortamiento que puede obtenerse al contraerse contra una poscarga determinada (gráfica inferior de la izquierda). También reduce la magnitud de la poscarga que el músculo cardíaco puede desplazar a una velocidad determinada. Sin embargo, el aumento de la precarga tiene el efecto opuesto sobre la contracción, tras la poscarga. La disminución de la longitud inicial (con contractilidad constante) produce menores velocidades de acortamiento para una poscarga determinada. Por su parte, toda la relación fuerza-velocidad para cualquier precarga determinada puede desplazarse por el estado inotrópico del corazón; es decir, las influencias inotrópicas positivas desplazan la curva fuerza-velocidad para cualquier carga determinada hacia arriba y hacia la derecha, por lo cual, una sustancia inotrópica positiva (por ejemplo, catecolaminas) permite que el músculo cardíaco desplace una carga más pesada a mayor velocidad de lo que es posible con un miocardio normal para la misma precarga (gráfica inferior de la derecha). Consecuentemente, los inotrópicos negativos tienen el efecto opuesto. El aumento de la contractilidad produce un aumento de la velocidad de acortamiento para una longitud muscular constante, pero no hay tendencia a que las curvas converjan con las fuerzas bajas y, por lo tanto, la Vmáx es proporcional al estado inotrópico del miocardio. Fernández, V. H. 348 Por ello, a diferencia de lo que ocurre con el músculo esquelético, la velocidad teórica máxima de los ciclos de entrecruzamientos, o Vmáx, en el músculo cardíaco no es constante, y puede considerarse a la Vmáx como un reflejo del estado inotrópico del corazón. Sin embargo, al no poder medirse directamente, es posible utilizar los índices que se relacionan con la Vmáx para calcular el estado de la contractilidad del miocardio (ver gasto cardíaco). Efecto de la frecuencia cardíaca (fenómeno de Bowditch y la regulación homeométrica) Los cambios de la frecuencia cardiaca (FC) también influyen sobre la contractilidad cardiaca puesto que, a medida que aumenta la FC, entra más Ca2+ a las células por cada minuto, hay una acumulación de Ca2+ intracelular y se libera una mayor cantidad de Ca2+ hacia el sarcoplasma con cada potencial de acción. De este modo, un incremento repentino de la frecuencia de latidos va seguido por un aumento progresivo de la fuerza contráctil. Una disminución en la FC ejerce un efecto opuesto. Este efecto es el fenómeno de escalera (Treppe) o de Bowditch. Este efecto forma parte de la regulación homeométrica del inotropismo, ya que no depende de la longitud de las sarcómeras. Asimismo, el aumento de la FC supone un importante incremento del trabajo, porque aumenta de forma importante el trabajo miocárdico. Es importante saber que el mayor trabajo implica mayor consumo de energía. En este sentido, el corazón obtiene la energía de la creatinafosfato y del ATP, con poca capacidad para conseguir energía de la glucólisis anaerobia dado que no tiene tiempo de reposo suficiente para un débito de O2 como sí lo muestra el músculo esquelético. Para ello, la utilización de sustrato implica la captación celular de ácidos grasos libres fundamentalmente y su posterior metabolización por β- oxidación (60 a 90% del metabolismo energético es aportado por estos), glucosa para la glucólisis, ácido láctico y la incorporación de los metabolitos resultantes al ciclo de Krebs, seguido de la síntesis de ATP mediante fosforilación oxidativa por la cadena respiratoria mitocondrial. Luego se genera la transferencia de energía desde el ATP a la molécula “reservorio” creatina, mediante la Creatinafosfocinasa (CPK) mitocondrial. El transbordador de creatina fosfato incrementa las funciones de la creatina fosfato como un amortiguador de energía al actuar como un sistema dinámico para la transferencia de fosfato de alta energía desde mitocondrias en tejidos activos como el corazón y el músculo estriado. Una Fernández, V. H. 349 isoenzima de la creatina cinasa (CKm)1 se encuentra en el espacio intermembrana mitocondrial, catalizando la transferencia de fosfato de alta energía hacia creatina desde ATP que surge a partir del transportador de nucleótido adenina. A su vez, la creatina fosfato se transporta hacia el citosol por medio de poros de proteína en la membrana mitocondrial externa, el cual queda disponible para la generación de ATP extramitocondrial. La creatinafosfato es una importante fuente de energía en condiciones de aumento de demanda, dado que permite generar ATP a una tasa 10 veces superior a la máxima capacidad de la fosforilación oxidativa. El corazón sintetiza diariamente 70 veces su peso en ATP, unos 30 kg, transformando apenas 25% de esta producción en TE. Por lo expuesto, el trabajo del corazón es muy dependiente del aporte de O2 y, por ende, del flujo sanguíneo coronario. El valor medio de consumo de O2 en reposo es de aproximadamente 0,08 a 0,1 ml/min/g de tejido. Para un corazón con una masa de 300 g el consumo de O2 miocárdico (MVO2) es de 24 a 30 ml/min, lo que supone un 10% de todo el MVO2 de un sujeto en reposo. Con el incremento del trabajo (por ejemplo, ejercicio) puede aumentar el consumo a unos 70 ml/min por cada 100 g de tejido (alrededor de 210 ml/min). RELAJACIÓN (LUSITROPISMO) Después de la contracción del miocito, es crucial que exista un sistema eficaz para reducir el Ca2+ citosólica, con el fin de producir relajación y permitir el llenado ventricular durante la diástole. La Ca2+-ATPasa del RS (SERCA) se activa por el aumento de la concentración de Ca2+ citosólica y bombea alrededor del 80 a 90% del Ca2+ de vuelta al RS. El fosfolamban (no fosforilado) inhibe la Ca2+-ATPasa del RS, pero cuando se fosforila por acción de la PKA (estímulo proveniente de las catecolaminas), se ejerce menos inhibición de la ATPasa (por ende, se activa la bomba de calcio), de modo que la captación de Ca2+ aumenta (efecto lusitrópico positivo), haciendo que se relaje mucho más rápido. El resto del Ca2+ citosólico se elimina de la célula por el intercambiador 3Na+/Ca2+ de la membrana plasmática en un 10 a 15% aproximadamente, que utiliza el gradiente de Na+ creado por la actividad de la Na+/K+-ATPasa para eliminar el Ca2+ de la célula. Un 5% del Ca2+ citosólico, aproximadamente, es extruido de la célula mediante la bomba de Ca2+-ATPasa sarcolémica. Es importante recordar que el glucósido cardiaco digital, disminuye la actividad de la bomba de Na+/K+-ATPasa y, así, reduce el gradiente de sodio, lo que da por resultado un incremento del Ca2+ intracelular que queda secuestrado en el SR. Este mecanismo contribuye de manera importante al efecto positivo de los glucósidos cardiacos sobre la fuerza contráctil del corazón insuficiente. FACTORES QUE INFLUYEN SOBRE LAS PROPIEDADES DEL CORAZÓN Existen muchos factores que pueden alterar la frecuencia cardiaca. Algunos de ellos pueden ser banales mientras que otros pueden comprometer la vida, éstos incluyen varios iones y varias hormonas circulantes, así como influencias físicas, como la temperatura y la distensión 1 CKm, creatina cinasa mitocondrial que media la producción de fosfato de creatina desde el ATP formado en la fosforilación oxidativa; CKa, creatina cinasa relacionada con requerimientos grandes de ATP, por ejemplo, la contracción muscular; CKc, creatina cinasapara mantener el equilibrio entre creatina y fosfato de creatina y ATP/ADP; CKg, creatina cinasa que acopla la glucólisis a la síntesis de fosfato de creatina; P, proteína de poro en la membrana mitocondrial externa. Fernández, V. H. 350 de la pared auricular. Todos actúan al alterar el tiempo requerido para que la membrana en reposo se despolarice hasta el potencial umbral. ✓ La temperatura afecta a la frecuencia del marcapasos. Esto explica que la frecuencia cardíaca aumente cuando una persona tiene fiebre. Se estima que la frecuencia se incrementa unos 10 lpm por cada grado centígrado de aumento de temperatura. ✓ Recordemos que la hiperpotasemia puede provocar trastornos severos del ritmo cardíaco que comprometen la vida del paciente. Inicialmente provocan un aumento de la excitabilidad miocárdica (aproximación del potencial de reposo al potencial umbral), alterando posteriormente la repolarización, lo que reduce la sensibilidad a los nuevos estímulos y disminuye la conducción (efecto dromotrópico negativo) y provoca arritmias lentas, bloqueos AV, paro sinusal y asistolia (ver más adelante). Esto ocurre porque la mayoría de los Nav quedan inactivados y el PARR es reemplazado por una respuesta lenta dirigida por canales lentos del Ca2+. ✓ La hipopotasemia es un trastorno grave, pero no es letal en tan poco tiempo como sí ocurre en la hiperpotasemia. La hiperpolarización de la membrana produce un efecto cronotrópico y dromotrópico negativos. ✓ Una hipercalcemia tiende a disminuir la frecuencia cardiaca al cambiar el potencial umbral alejándolo del reposo. Sin embargo, es poco el efecto que se observa en la fase 0 del potencial de acción dado que el aumento de Ca2+ extracelular favorece a la actividad de los canales de Ca2+ tipo L los cuales se cierran más rápido, acortando el tiempo de la fase 2 y, por lo tanto, produciendo un aumento en la frecuencia cardíaca. Esto se debe a que la concentración de Ca2+ intracelular desempeña un papel fundamental en el proceso de inactivación de estos canales. La regulación por el Ca2+ intracelular es un proceso fisiológico que proporciona un mecanismo que evitaría una sobrecarga de Ca2+ en los cardiomiocitos. La calmodulina parece jugar un papel central en este proceso, dado que se encuentra unida a la porción C-terminal de una de sus subunidades (α1C) en reposo actuando como sensor. También existe una inactivación dependiente de voltaje, con lo cual, la regulación de estos canales es compleja y depende del equilibrio entre estos dos fenómenos. En la hipercalcemia puede observarse en el electrocardiograma (ECG) un intervalo QT corto, a expensas del acortamiento del segmento ST que representa la meseta del potencial. ✓ La hipocalcemia puede producir bradicardia por retardo en la repolarización de la fase 2 del PARR y menor pendiente en la fase 0 del PARL. ✓ Un aumento de la actividad simpática incrementa, mediante la acción del AMPc, la entrada de Na+ por los HCN y la entrada de Ca2+ en la fase 0 del PARL aumentando la velocidad de despolarización de marcapasos, lo que hace que la célula alcance el umbral más rápido y aumenta la frecuencia de descarga de potenciales de acción (efecto cronotrópico positivo). Asimismo, se produce un aumento en la conductibilidad (efecto dromotrópico positivo). El aumento en la entrada de Ca2+ extracelular y la mayor salida de Ca2+ del RS, produce un aumento en la contractilidad (efecto inotrópico positivo). ✓ Un aumento de la actividad parasimpática produce una caída en la pendiente de la fase 4 debido a que aumenta la permeabilidad al K+ haciendo más negativo el PDM, y disminuye la fase 0 del PARL porque disminuye la permeabilidad al Ca2+ por los canales tipo T y L, con lo cual, produce una disminución en la frecuencia cardíaca (efecto cronotrópico negativo). Asimismo, disminuye la velocidad de conducción (efecto dromotrópico negativo). Dada la característica de la inervación cardíaca por parte del sistema parasimpático, el efecto inotrópico negativo es más evidente en las aurículas, por un decremento de la duración del potencial de acción, y de la cantidad de Ca2+ que entra a la célula durante el potencial de acción. ✓ Agentes bloqueantes de canales de calcio afectan el movimiento del Ca2+ en este sitio de la membrana celular. Para bloquear los canales de Ca2+ de tipo L, los antagonistas del Ca2+ Fernández, V. H. 351 presentan dependencia del uso y dependencia del voltaje. La dependencia del uso significa que cuantas más veces se abra el canal, mayor va a ser el bloqueo. Así, en particular para el caso del verapamilo y el diltiazem, el bloqueo de la entrada de Ca2+ aumenta de forma marcada a frecuencias más rápidas. Los antagonistas del Ca2+ poseen efectos cronotrópico negativos (disminución de la frecuencia cardiaca), dromotrópico negativos (disminución de la conducción auriculoventricular) e inotrópicos negativos (reducción de la fuerza de contracción del miocardio). Estos efectos se ejercen de modo directo sobre el corazón y se contrarrestan, en parte, por la activación simpática refleja, vía catecolaminas. Sin embargo, los efectos cardíacos son distintos para cada fármaco. A dosis clínicas, el nifedipino no afecta a la conducción auriculoventricular ni al nodo sinusal. Sin embargo, el verapamilo y el diltiazem aminoran la velocidad de disparo del marcapasos y enlentecen la conducción auriculoventricular, dos propiedades que constituyen la base de su indicación en el tratamiento de arritmias supraventriculares. Efecto de los antagonistas del calcio sobre la contractilidad y frecuencia cardíacas Fármaco Contractilidad Frecuencia cardíaca Acción sobre vasos sanguíneos (músculo liso) Verapamilo ↓↓ ↓↓ Muy baja Diltiazem ↓↓ ↓ Baja Nifedipino ↑ ↑↑ Alta APLICACIONES CLÍNICO-FISIOLÓGICAS Motivo de consulta: Marcelo T., de 45 años, ingresa a la guardia por presentar palpitaciones y mal estar general. Padecimiento actual: el paciente se presenta diaforético con taquicardia y disnea moderada. Antecedentes médicos: padre con ACV. Antecedentes personales de Apnea del Sueño desde hace más de 5 años. Múltiples internaciones y consultas a servicio de emergencias. Examen físico: IMC de 28 kg/m2. FC de 120 lpm. FR de 27/min. TA 138/85 mmHg. Resto del examen fue normal. Hospitalización: queda en emergencias para estudios. La FC disminuyó a 80 lpm. Estudios: Laboratorio normal incluyendo hormonas tiroideas. Rx Tórax, ECG, Holter y ECO Doppler normales. Diagnóstico: Fibrilación Auricular paroxística sintomático. Tratamiento: se trata al paciente con aspirina y se evalúa cardioversión de la FA. Puntos de reflexión 1. ¿Cuál es el fundamento electrofisiológico de la FA? 2. En la fibrilación auricular, las aurículas no generan actividad eficaz, ¿por qué? 3. ¿Cuál es el fundamento de tratar con aspirina al paciente? Fernández, V. H. 352 Correlato entre la fisiología y la clínica La fibrilación auricular (FA) fue identificada en humanos por Lewis en 1909, años más tarde Mackenzie describió sus características ECG. Es la arritmia cardiaca sostenida más frecuente y la mayor causa de internación por arritmias. Afecta de 2 o 3 pacientes/1.000 entre los 55 y 64 años, aumentando a 75-90/1.000 en > 85 años. Cerca del 10% de los mayores de 85 años tiene historia de FA. La arritmia está asociada con fenómenos embólicos, desarrollo de insuficiencia cardiaca y deterioro de la función ventricular; además, es un factor de riesgo de mortalidad independiente, con un riesgo relativo de 1,5 en los varones y 1,9 para las mujeres. La FA es una taquiarritmia supraventricular caracterizada por una activación auricular rápida, entre 400 y 700 ciclos por minuto, de forma desorganizada, con el consecuente deterioro de la función mecánica auricular. El electrocardiograma (ECG) muestra ausencia de onda P y la presencia de oscilacionesrápidas u ondas fibrilatorias (ondas f) que varían en forma, tamaño e intervalo. Estas, se asocian frecuentemente a una respuesta ventricular rápida e irregular, esto, siempre y cuando la función de la UAV sea normal. La respuesta ventricular en todo caso dependerá de las propiedades de conducción de la UAV, la actividad simpática o parasimpática y la influencia de algunos fármacos. Libros sugeridos ✓ Alexánderson Rosas, E. (2010). Exploración cardiovascular: bases fisiopatológicas. México: Editorial El Manual Moderno. ✓ Alexánderson Rosas, E. Gamba Ayala, G. (2014). Fisiología cardiovascular, renal y respiratoria. 1ª ed. México: Editorial El Manual Moderno. ✓ Barrett, K. E. Barman, S, M. Boitano, S. Brooks, H. L. (2013) Ganong. Fisiología médica. 24ª edición. McGraw-Hill/Interamericana Editores S.A. de C.V. ✓ Drake, R. L. Vogl, A. W. Mitchell, A. W. M. (2010). Gray. Anatomía para estudiantes. Segunda edición. Elsevier España. ✓ Fuster, V. Harrington, R. A. Narula, J. Eapen, Z. J. (Eds.) (2017). Hurst's The Heart. 14 edition. New York: McGraw-Hill Education. ✓ Hall, J. E. (2016) Guyton y Hall. Tratado de Fisiología. 13 ed. Elsevier. ✓ Heller, L. J. Mohrman, D. E. (2013). Células de músculo cardiaco. En Fisiología Médica. Un enfoque por aparatos y sistemas. 5(23), 211-222. McGraw-Hill. Interamericana. ✓ Laso, F. J. (2010). Introducción a la medicina clínica. Fisiopatología y semiología. 2ª edición. España: Elsevier. ✓ Pró, E. (2012). Anatomía clínica. 1ª ed. Buenos Aires: Editorial Médica Panamericana ✓ Raff, H. Levitzky, M. (2013) Fisiología médica. Un enfoque por aparatos y sistemas. McGraw-Hill/Interamericana Editores S.A. de C.V. ✓ Rhoades, R. A. Bell, D. R. (2018). Fisiología Médica: Fundamentos de Medicina Clínica. Lippincott Williams & Wilkins. ✓ Rodwell, V. W. Bender, D. A. Botham, K. M. Kennelly, P. J. Weil, P. W. (2016). Harper. Bioquímica ilustrada. 30ª edición. México: McGraw-Hill Interamericana Editores, S.A. de C. V. ✓ Saladin, K. S. (2013). Anatomía y Fisiología. La unidad entre forma y función. Sexta edición. The McGraw-Hill Companies, Inc. ✓ Tresguerres, J. A. F. Ariznavarreta, C. Cachofeiro, V. Cardinali, D. Escrich Escriche, E. Gil-Loyzaga, P. Lahera Juliá, V. Mora Teruel, F. Romano Pardo, M. Tamargo Menéndez, J. (2005). Fisiología Humana. 3ª edición. McGraw-Hill Interamericana. España. Fernández, V. H. 353 Trabajos originales ✓ Bodi, I. Mikala, G. Koch, S. E. Akhter, S. A. Schwartz, A. (2005). The L-type calcium channel in the heart: the beat goes on. Journal of Clinical Investigation, 115(12), 3306– 3317. ✓ Castro, P. Gabrielli, L. Verdejo, H. Greig, D. Mellado, R. Concepción, R. et al. (2010). Metabolismo energético del corazón y sus proyecciones en el tratamiento de la insuficiencia cardíaca. Revista médica de Chile, 138(8), 1028-1039. ✓ DiFrancesco, D. Ferroni, A. Mazzanti, M. Tromba, C. (1986). Properties of the hyperpolarizing-activated current (If) in cells isolated from the rabbit sino-atrial node. J Physiology; 377: 61-88. ✓ Farías, J. M. Mascher, D. Paredes-Carbajal, M. C. Torres-Durán, P. V. Juárez-Oropeza, M. A. (2010). El marcapaso del corazón puede ser modulado por la acetilcolina mediante una vía delimitada a la membrana. Revista de Educación Bioquímica, 29(2), 29-38. ✓ Gaztañaga, L., Marchlinski, F. E. Betensky, B. P. (2012). Mecanismos de las arritmias cardiacas. Revista Española de Cardiología, 65(2), 174-185. ✓ Guerra, J. M. Cinca, J. (2007). Ritmo sinusal normal. Nuevos conceptos anatómicos y fisiológicos del nódulo sinusal. Corriente If. Revista Española de Cardiología Suplementos, 7(4), 26-31. ✓ Ho, S. Y. (2003). Anatomía de los nodos cardíacos y del sistema de conducción específico auriculoventricular. Revista Española de Cardiología, 56(11), 1085-1092. ✓ Izaguirre, V. Zavaleta, A. I. (1998). Canales de calcio voltajes dependientes. Ciencia e Investigación, 1(1), 49-61. ✓ Mendoza-Medellín, A. Torres-Velázquez, G. (2015). Metabolismo energético del corazón normal e infartado. CIENCIA ergo-sum, 9(3), 282-292. ✓ Mora Pabón, G. (2005). Una forma poco usual de preexcitación: las fibras de Mahaim. Revista de la Facultad de Medicina, 53(3), 204-208. ✓ Olshansky, B. Sabbah, H. N. Hauptman, P. J. Colucci, W. S. (2008). Parasympathetic nervous system and heart failure. Circulation, 118(8), 863-871. ✓ Torrent-Guasp, F. (1998). Estructura y función del corazón. Revista Española de Cardiología, 51(2), 91-102. ✓ Trainini, J. C. Hereros, J. (2011). ¿El corazón es una bomba de succión? Revista argentina de cardiología, 79(1), 39-45. ✓ Vetulli, H. M. (2009). La corriente iónica If (“funny current”) y la aplicación de agentes moduladores en arritmología. Rev Electro y Arritmias; 2(4): 154-155.




![Fisiología_cardiaca[1]](https://files.passeidireto.com/Thumbnail/e74ea390-b3db-4c52-bb75-6466f077214e/105/1.jpg)
