
PRÁTICA 7:
Concentração Micelar Crítica
(CMC)
Introdução
•Surfactantes
•“Surface active agent ”
•Moléculas anfipolares
•Capazes de se dissolver tanto em meios polares quanto em meios apolares
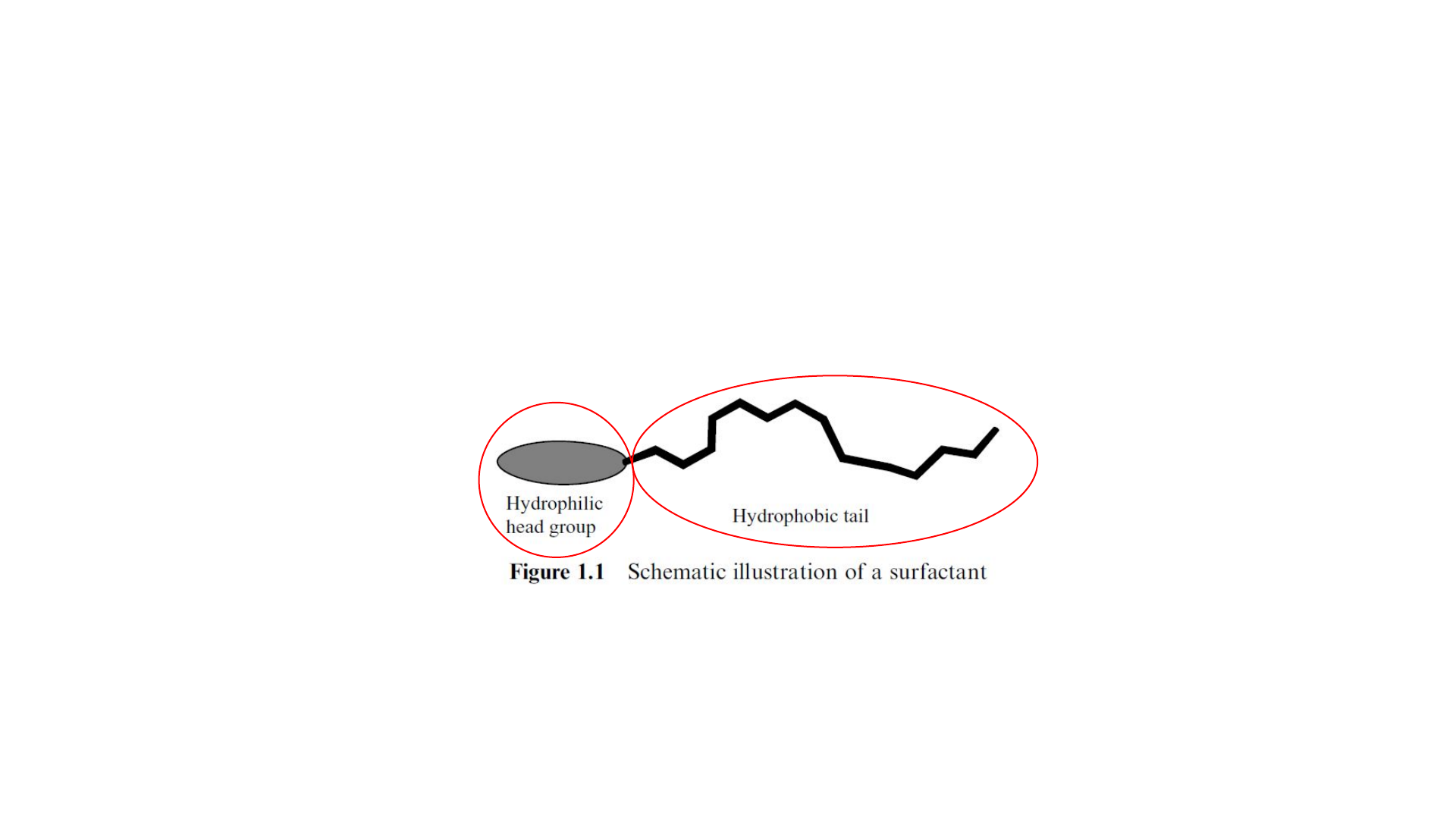
Surfactantes ou tensoativos são moléculas que
apresentam sua estrutura dividida em duas partes, uma
de pequenas dimensões e que apresenta polaridade,
chamada “cabeça”, e outra apolar e de grandes
dimensões, denominada “cauda”. Devido à essa
anfipolaridade os surfactantes apresentam características
únicas, como a capacidade de dissolver em meios
apolares e polares.
Introdução
•Classificação dos surfactantes
•Não iônicos
•Iônicos
•Aniônicos
•Catiônicos
•Anfóteros ou Zwitteriônicos
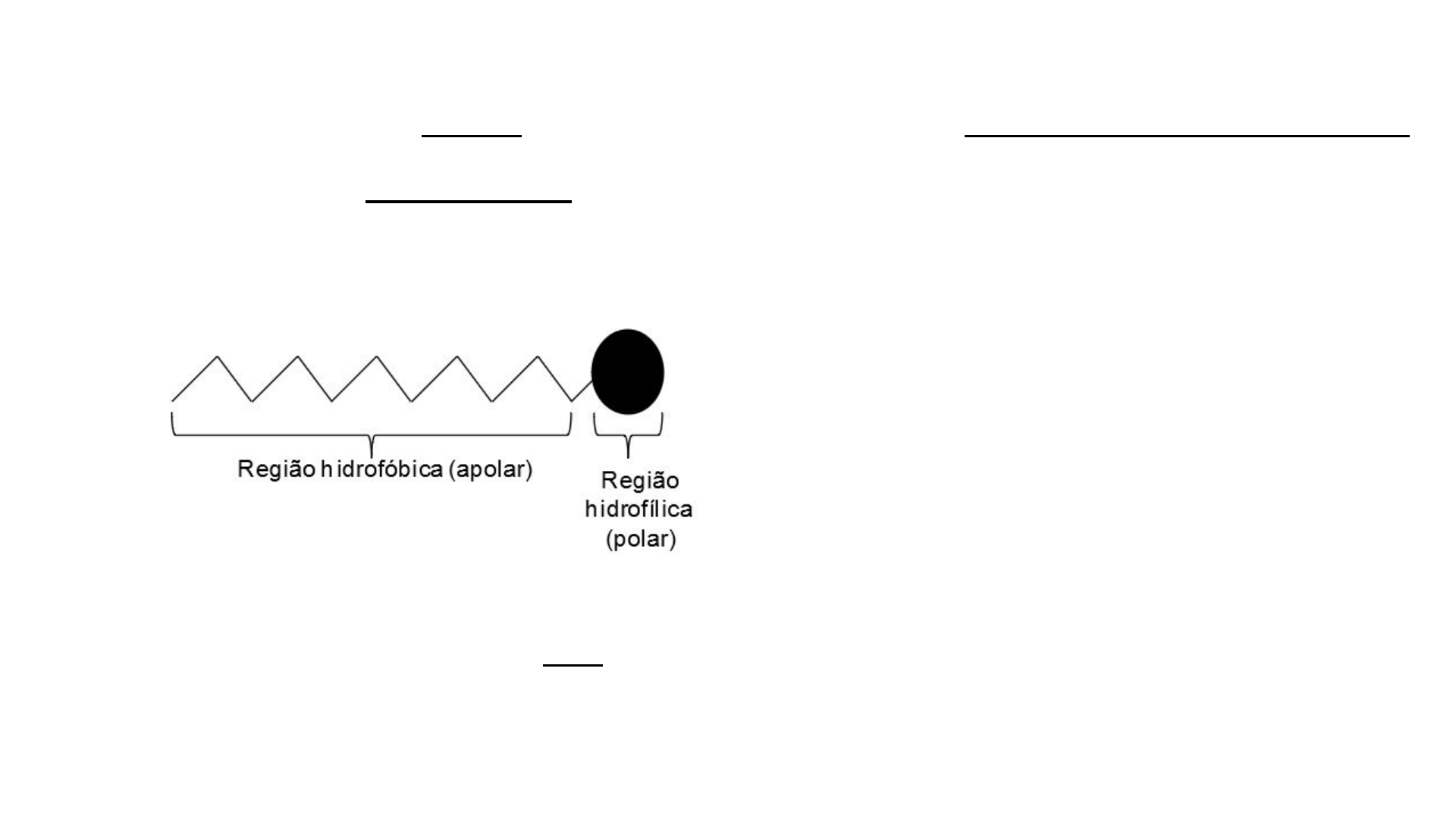
Compostos tensoativos ou surfactantes são substâncias orgânicas que apresentam como característica principal o
fato de terem um comportamento anfifílico , ou seja, podem interagir tanto com substâncias polares quanto apolares .
Essa propriedade é explicada pelo fato dessas moléculas apresentarem uma região hidrofóbica e outra hidrofílica. A
parte hidrofóbica, que é uma cadeia carbônica interage com substâncias apolares, e a hidrofílica ou iônica com
substâncias polares.
A estrutura orgânica de um tensoativo está esquematizada abaixo:
https://www.infoescola.com/wp-content/uploads/2019/02/audio_148778.mp3?version=1629148935
H3C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C-OSO3Na ⇒
H3C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C- H2C-OSO3
- + Na+
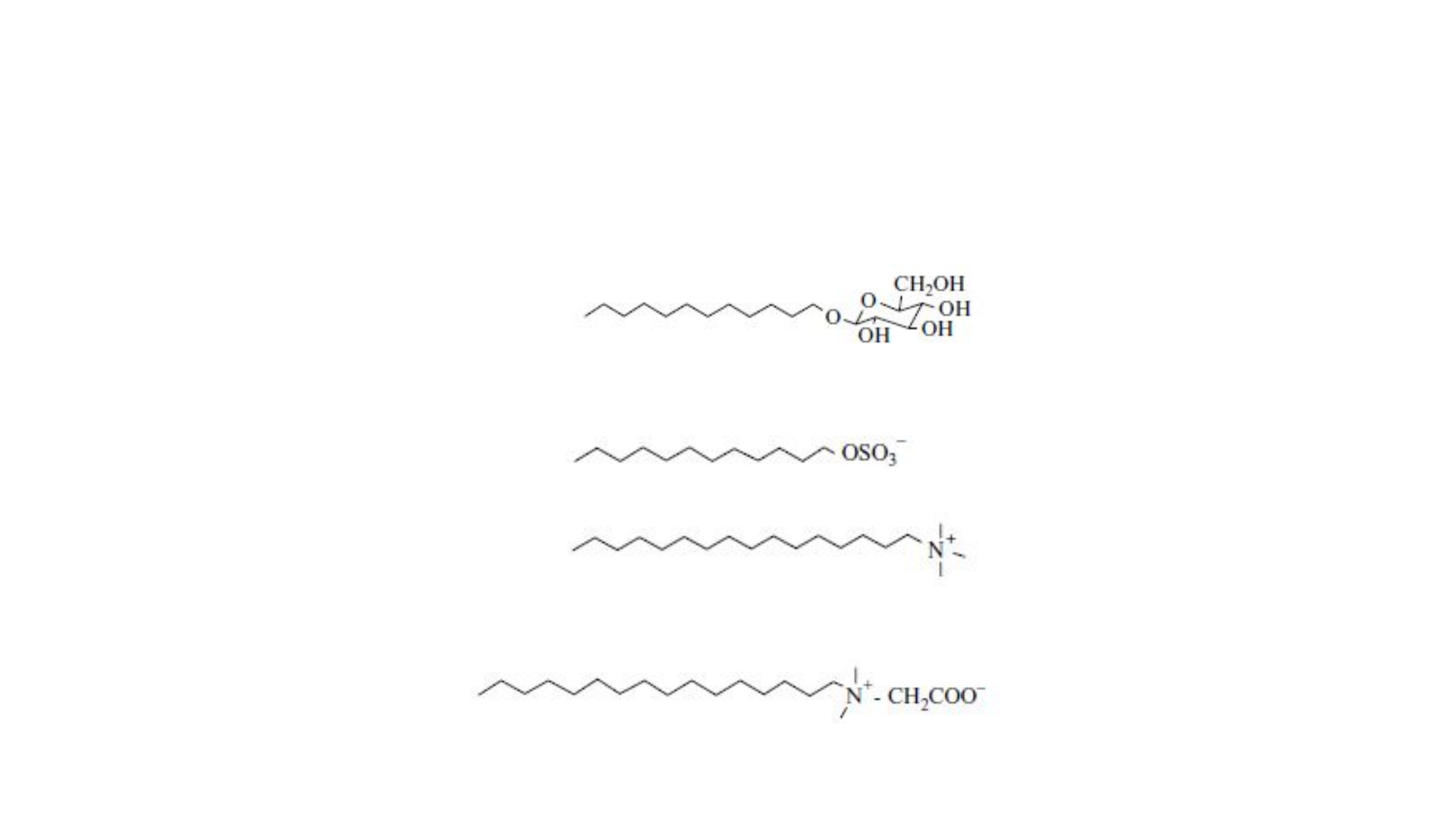
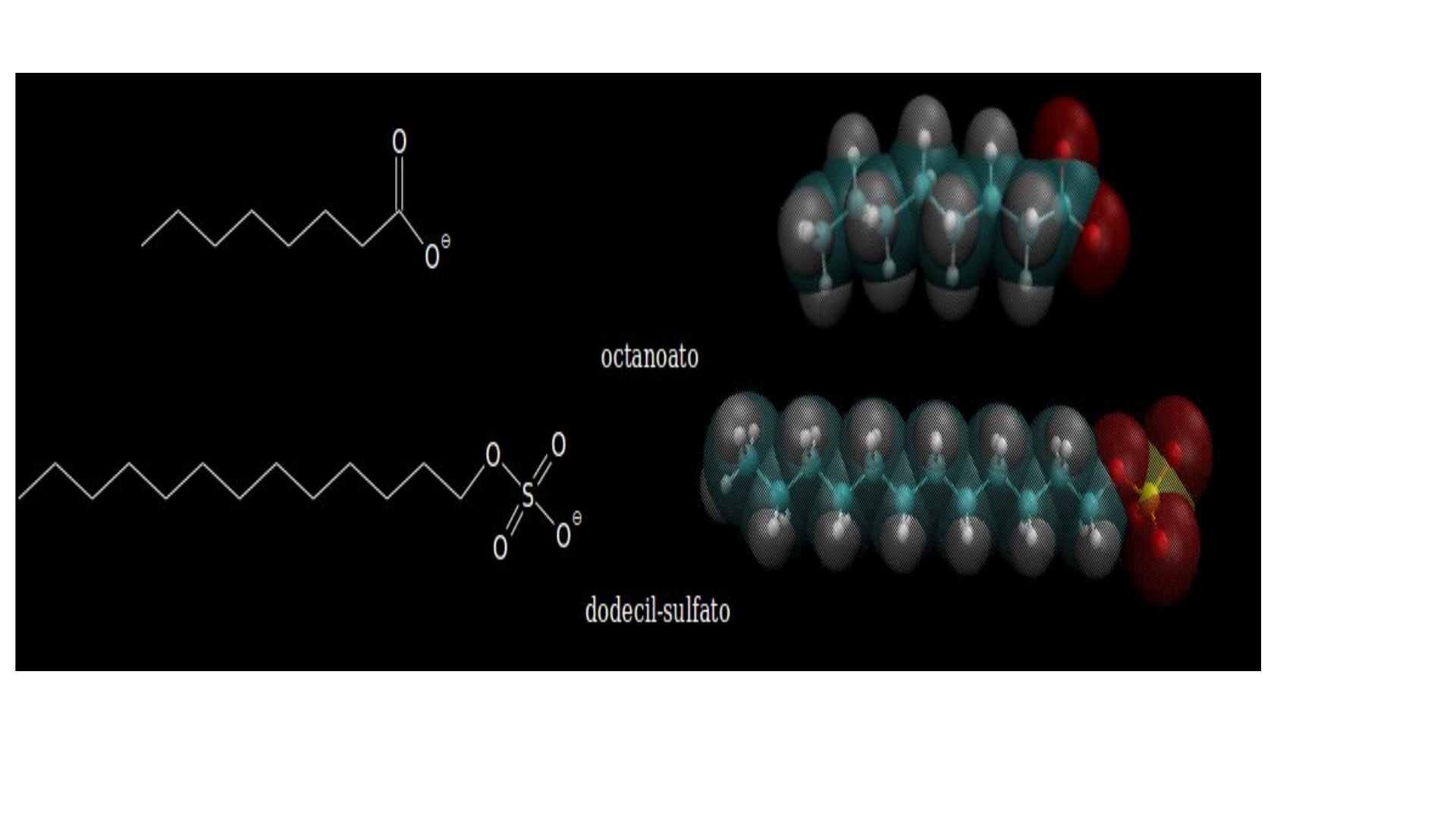
Esses compostos podem ser classificados em tensoativos aniônico, catiônicos, não iônicos ou anfóteros. Os aniônicos
ao serem dissolvidos em água, dissociam-se de forma que a cadeia carbônica forme um ânion. Um exemplo desse tipo
de tensoativo é o lauril ou dodecilsulfato de sódio, muito utilizado em xampus.

MICELIZAÇÃO
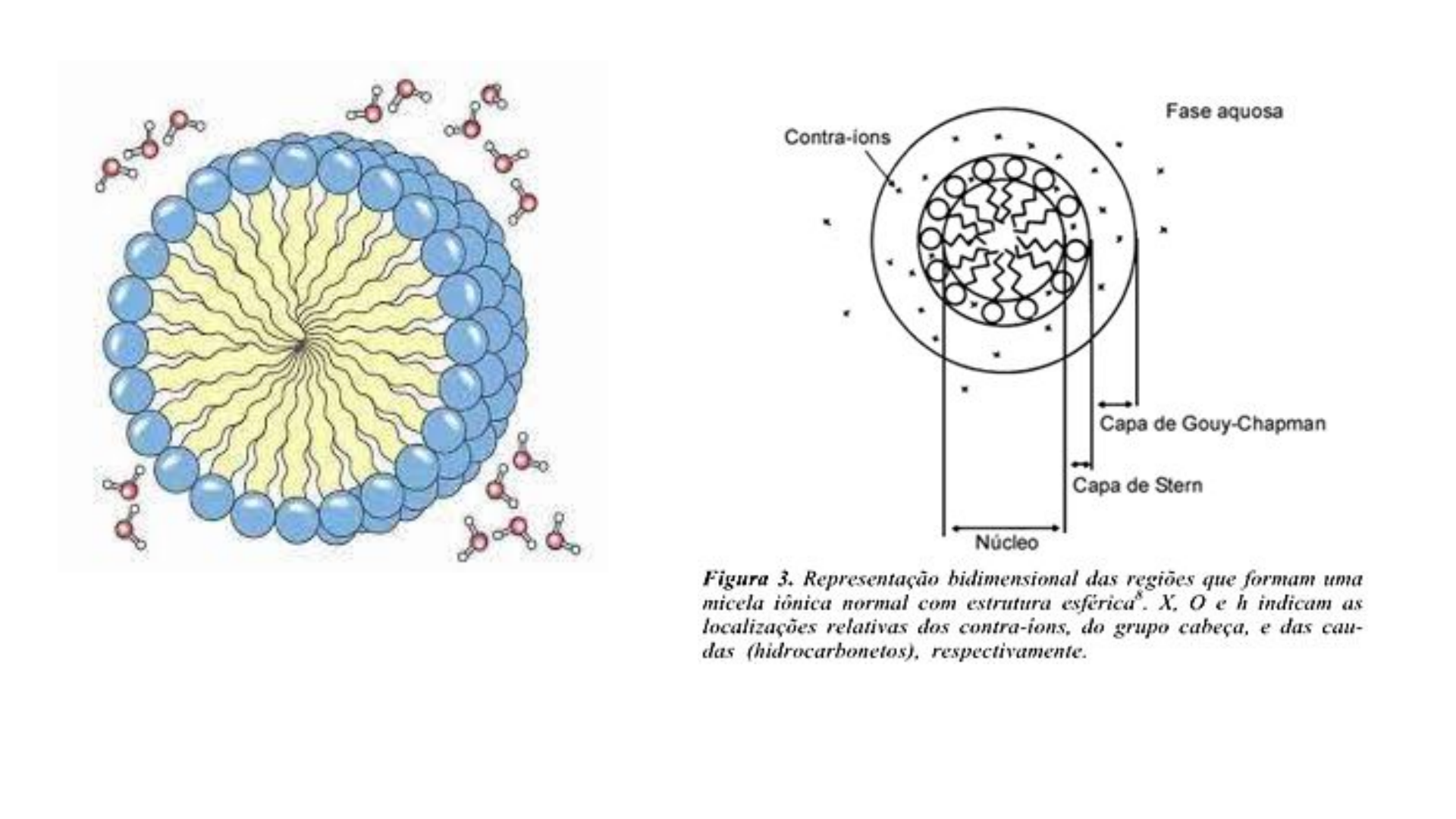
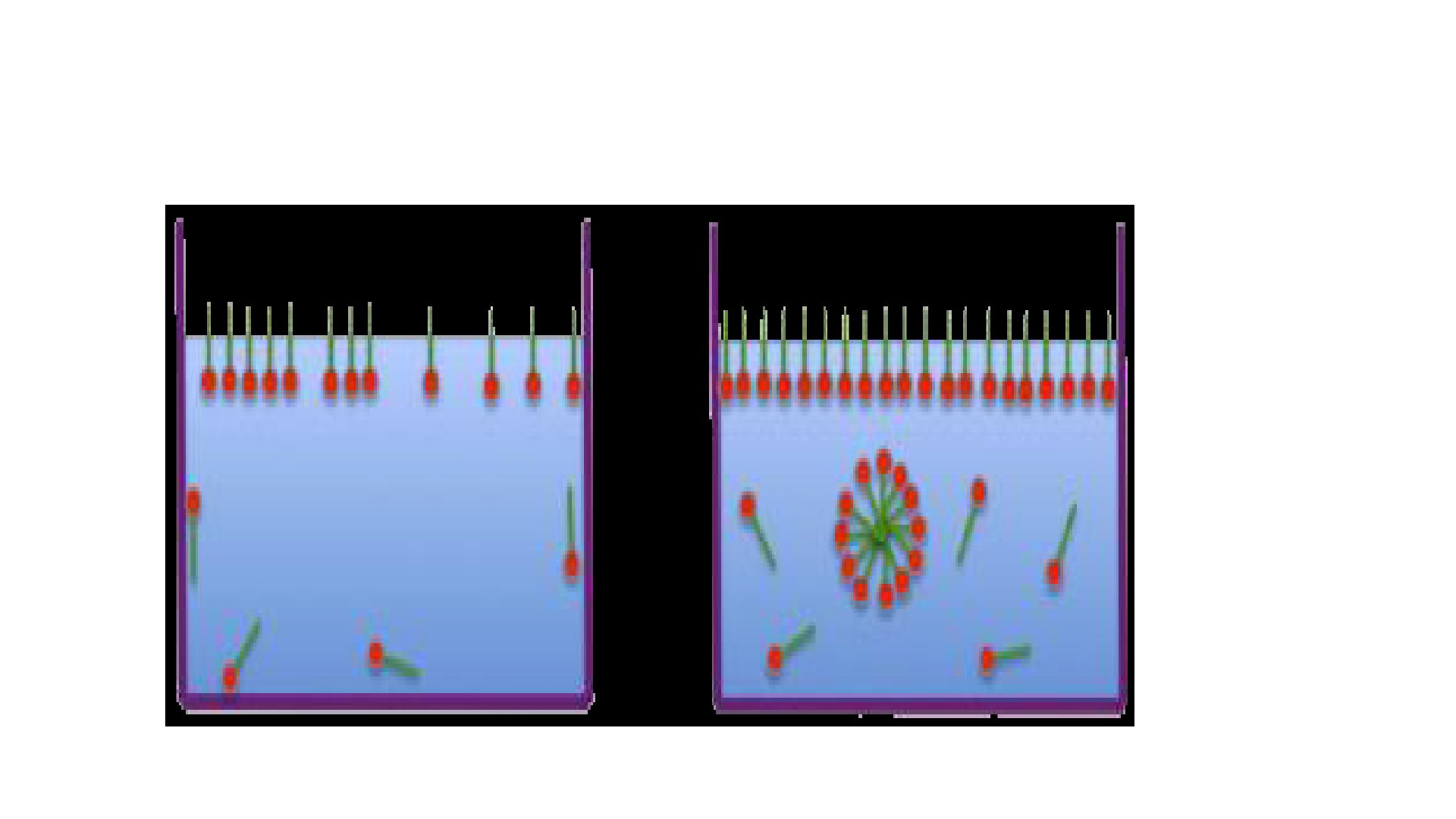
O aumento da concentração de um surfactante em um meio qualquer gera um fenômeno
conhecido como Micelização, isto é, a formação de micelas. A micela é uma estrutura globular
formada pela união de várias moléculas de surfactante e tem como objetivo minimizar a
superfície de contato entre o solvente e a parte da cadeia do surfactante que interage
repulsivamente ao solvente. Por exemplo, de acordo com a figura 1, a micela (a) se forma em
solvente polares, pois as cabeças polares voltam-se para o solvente, escondendo as cadeias
hidrofóbicas; do mesmo modo, a micela (b) se forma em meios apolares, para que a interação
solvente-cauda apolar seja intensificada, enquanto as partes polares permanecem no interior da
estrutura
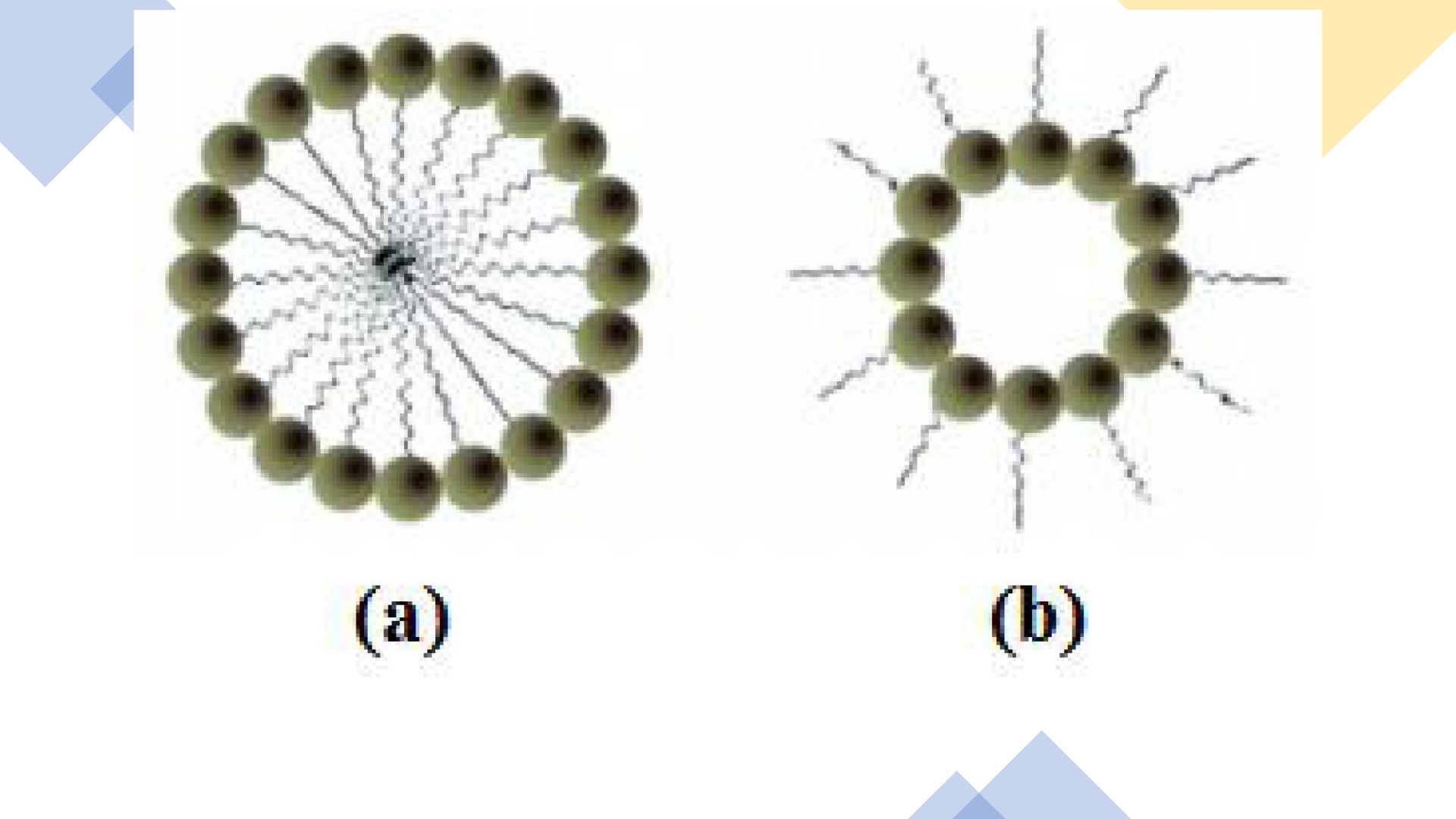
Figura 1: Dois tipos de formação micelar distintos: (a) - meios polares; (b) - meios apolares.
FORMAÇÃO DE MICELAS
Introdução
•Determinação experimental da CMC
•Requer a escolha de uma propriedade cuja variação pode
ser facilmente detectável a partir da formação de micelas
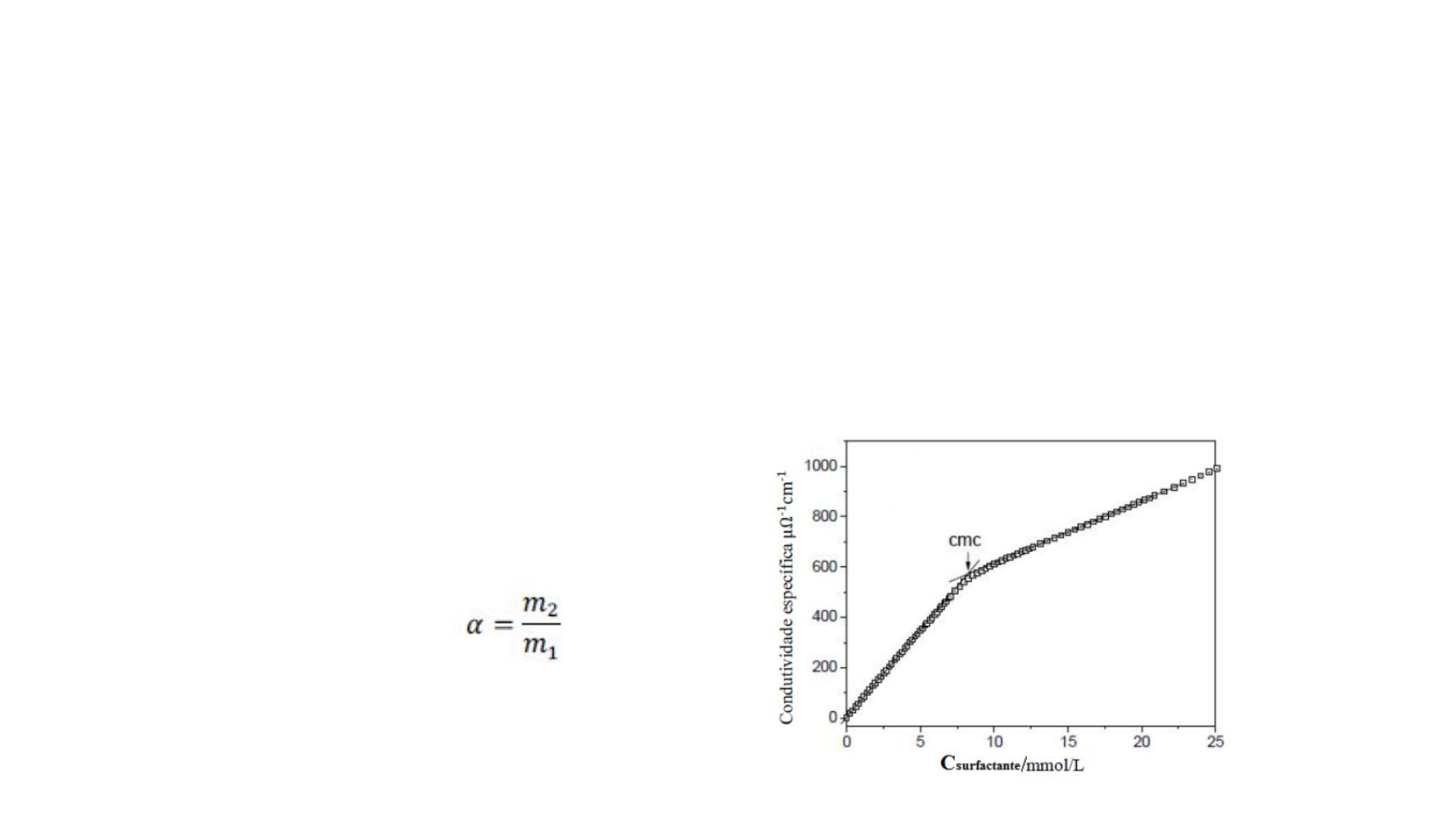
•Surfactantes iônicos → Condutividade elétrica
•Dado importante que podem
ser obtidos por esse método:
•Grau de ionização da micela!
Prévia do material em texto
PRÁTICA 7: Concentração Micelar Crítica (CMC) Introdução • Surfactantes • “Surface active agent” • Moléculas anfipolares • Capazes de se dissolver tanto em meios polares quanto em meios apolares Surfactantes ou tensoativos são moléculas que apresentam sua estrutura dividida em duas partes, uma de pequenas dimensões e que apresenta polaridade, chamada “cabeça”, e outra apolar e de grandes dimensões, denominada “cauda”. Devido à essa anfipolaridade os surfactantes apresentam características únicas, como a capacidade de dissolver em meios apolares e polares. Introdução • Classificação dos surfactantes • Não iônicos • Iônicos • Aniônicos • Catiônicos • Anfóteros ou Zwitteriônicos Compostos tensoativos ou surfactantes são substâncias orgânicas que apresentam como característica principal o fato de terem um comportamento anfifílico, ou seja, podem interagir tanto com substâncias polares quanto apolares. Essa propriedade é explicada pelo fato dessas moléculas apresentarem uma região hidrofóbica e outra hidrofílica. A parte hidrofóbica, que é uma cadeia carbônica interage com substâncias apolares, e a hidrofílica ou iônica com substâncias polares. A estrutura orgânica de um tensoativo está esquematizada abaixo: https://www.infoescola.com/wp-content/uploads/2019/02/audio_148778.mp3?version=1629148935 H 3 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C-OSO 3 Na ⇒ H 3 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C- H 2 C-OSO 3 - + Na+ Esses compostos podem ser classificados em tensoativos aniônico, catiônicos, não iônicos ou anfóteros. Os aniônicos ao serem dissolvidos em água, dissociam-se de forma que a cadeia carbônica forme um ânion. Um exemplo desse tipo de tensoativo é o lauril ou dodecilsulfato de sódio, muito utilizado em xampus. https://www.google.com/url?q=https://www.infoescola.com/quimica/sistema-anfifilico/&sa=D&source=editors&ust=1633395051488000&usg=AOvVaw1Pj-LMKAAc1yxzvQC8d3IN https://www.google.com/url?q=https://www.infoescola.com/quimica/polaridade/&sa=D&source=editors&ust=1633395051488000&usg=AOvVaw1lQmX2fRiv-57jnGfwcR1R https://www.google.com/url?q=https://www.infoescola.com/quimica/cadeia-carbonica/&sa=D&source=editors&ust=1633395051488000&usg=AOvVaw3E1B2gdOUEAJJKACm9cOVd https://www.google.com/url?q=https://www.infoescola.com/elementos-quimicos/sodio/&sa=D&source=editors&ust=1633395051710000&usg=AOvVaw3SQM6y7SHqbPOKlIrAPLS5 MICELIZAÇÃO O aumento da concentração de um surfactante em um meio qualquer gera um fenômeno conhecido como Micelização, isto é, a formação de micelas. A micela é uma estrutura globular formada pela união de várias moléculas de surfactante e tem como objetivo minimizar a superfície de contato entre o solvente e a parte da cadeia do surfactante que interage repulsivamente ao solvente. Por exemplo, de acordo com a figura 1, a micela (a) se forma em solvente polares, pois as cabeças polares voltam-se para o solvente, escondendo as cadeias hidrofóbicas; do mesmo modo, a micela (b) se forma em meios apolares, para que a interação solvente-cauda apolar seja intensificada, enquanto as partes polares permanecem no interior da estrutura Figura 1: Dois tipos de formação micelar distintos: (a) - meios polares; (b) - meios apolares. FORMAÇÃO DE MICELAS Introdução • Determinação experimental da CMC • Requer a escolha de uma propriedade cuja variação pode ser facilmente detectável a partir da formação de micelas • Surfactantes iônicos → Condutividade elétrica • Dado importante que podem ser obtidos por esse método: • Grau de ionização da micela! DETERMINA ̇ˆO DA CONCENTRA ̇ˆO MICELAR CRÍICA DE ÁCIDOS HÚMICOS POR MEDIDAS DECONDUTIVIDADE E ESPECTROSCOPIA Solange Leite de Moraes* e Maria Olímpia Oliveira Rezende Instituto de Química de Sªo Carlos, Universidade de Sªo Paulo, Av. Trabalhador Sªocarlense , 400, 13560-970 Sªo Carlos – SP Quim. Nova, Vol. 27, No. 5, 701-705, 2004 Procedimento Medidas de Condutividade https://www.google.com/url?q=https://docs.google.com/file/d/1ZFfQ0_xrbTf3i7pz1EjuS8boYLA-mDtC/preview&sa=D&source=editors&ust=1633395054381000&usg=AOvVaw1Yw85thuEg4E1BXv7IrJka SOLUÇÃO SDS 40 mmol/L 25 mL de àgua 1. Ferver 200 mL de água para eliminar o CO 2 dissolvido 2. Prepare 50 mL de uma solução 40 mmol/L do surfactante dodecilsulfato de sódio (SDS).Utilizar a água livre de CO 2 do item 1. 3. Através de uma bureta adicione pequenas quantidades, de 1,0 mL em 1,0 mL, da solução estoque de SDS em 25 mL de água preparada (água de coleta suficiente para cobrir a janela do eletrodo) em agitação constante. A cada adição, aguarde cerca de 20s, anote o valor de condutividade. Adicione no total de 25 mL da solução estoque. Calcular a concentração de SDS após cada adição da solução da bureta. V/mL k/ (μS.cm) CSDS/ mmolL- 1,0 96,34 2,0 167,5 3,0 242,4 4,0 306,7 5,0 368,5 6,0 423,4 7,0 462,7 8,0 483,8 9,0 502,2 10,0 520,5 11,0 536,1 12,0 551,2 13,0 567,0 14,0 580,5 15,0 593,9 16,0 607,1 17,0 619,9 18,0 629,6 19,0 638,6 20,0 646,3 21,0 659,9 22,0 669,8 23,0 677,3 24,0 685,7 25,0 692,9 Tratamento de Dados Experimentais. Determinação da CMC do surfactante (a) Faça um gráfico de condutividade versus a concentração do surfactante e determine o valor da CMC (ponto de descontinuidade). (b) Calcule o coeficiente angular das regiões abaixo e acima da CMC e determine o grau de ionização das micelas. Referências Bibliográficas • 1 – Apostila prática de Físico-Química Experimental da Universidade Federal do Espírito Santo, 2012. • 2 – Krister Holmberg, Bo Jönsson, Bengt Kronberg. Surfactants and Polymers in Aqueous Solution. John Wiley & Sons, Ltd, 2002 • 3 – Laurier L. Schramm. Emulsions, Foams and Suspensions. WILEY-VCH Verlag GmbH & Co, 2005. • 4 – Barney L. Bales. A Definition of the Degree of Ionization of a Micelle Based on Its Aggregation Number. J. Phys. Chem. B 2001, 105, 6798-6804.



