
1
SOLUB ILIDADE DOS COMP OS TOS ORGÂNICOS
VICTOR LOSSAVARO
UTFPR – Un iv er sid a d e Tec n o ló g ica Fe d e ra l d o Pa ra n á , Ca mpu s M e d ian e ira , En g e n h a ria d e
a lime n to s. M e d ian eira -PR, Bra sil.
Res umo
N este artigo demonstra- se a importância da solubilidade dos compostos, principalmente no dia a
dia de um laboratório, pois a maioria das reações acontecem em uma solução, além de demonstra r os
resultados obtidos. Nessa prática , é proposto que se determine a solubilidade de quatro compostos
desconhecidos, através de alguns solve ntes, que são eles: água, éter, N aO H 5%, N aHC O 3 5%, HC l 5%,
H2S O 4 95% e H3PO 4 85%. Após os testes em cada um desses solventes, compara - se o resultado na
tabela, para descobrir qual composto é.
Para se determinar a solubilidade de cada mistura, formada por um soluto e um solvente, é
necessário se atentar a teoria também, como a polaridade das ligações intermoleculares. A polaridade é um
dos fatores determinantes para saber se uma mistura será homogênea ou heterogênea, assim como a
eletronegatividade dos átomos de uma molécula, que segundo Linus Pauling, se a diferença entre elas for
próxima ou igual a zero, determina uma ligação apolar.
Pala v ra s cha ve s : solubilida de ; mistura ; solve nte ; soluto; pola rida de.
* Autore s c orre sponde nte s : vic tor_ lossa va ro@hotma il.c om
1 . Intr o duç ão
A solubilidade de uma substância é uma propriedade física muito importante qual se baseiam certos
métodos de separação de misturas, de extração de produtos naturais e de recristalização de
substâncias. Também é uma propriedade muito empregada nas indústrias de tintas, perfumes, sabão
e detergente, açúcares e plásticos. Ela depende da natureza do soluto, do solvente e da
temperatura. P ara prever o comportamento de certos solutos em relação a certos solventes (à
temperatura constante) é necessário se analisar as suas estruturas moleculares, ou melhor, o tipo de
interação que há entre soluto e solvente. (VO GEL, 1983)
2
O processo de solubilização de uma substância química resulta da interação entre a espécie que se
deseja solubilizar (soluto) e a substância que a dissolve (solvente), e pode ser definida como a quantidade
de soluto que dissolve em uma determinada quantidade de solvente, em c ondições de equilíbrio.
Solubilidade é, portanto, um termo quantitativo. É uma propriedade física (molecular) importante que
desempenha um papel fundamental no comportamento das substâncias químicas, especialmente dos
compostos orgânicos. (MARTINS , 2013)
A solubilidade de uma substância orgânica está diretamente relacionada com a estrutura molecular,
especialmente com a polaridade das ligações e da espécie química como um todo (momento de dipolo).
Geralmente, os compostos apolares ou fracamente polares são solúveis em solventes apolares ou de baixa
polaridade, enquanto que compostos de alta polaridade são solúveis em solventes também polares, o que
está de acordo com a regra empírica de grande utilidade: “polar dissolve polar, apolar dissolve apolar” ou
“o semelhante dissolve o semelhante”. Em alguns casos, a solubilidade de compostos orgânicos pode estar
relacionada com a ocorrência de uma reação química. Assim, essa propriedade pode ser dividida em duas
categorias: a solubilidade em que uma reação química é a força determinante (por exemplo, na reação
ácido- base) e a solubilidade na qual estão envolvidas somente as forças intermoleculares. (MARTINS ,
2013)
A prática tem como objetivo identificar compostos orgânicos atráves de testes de solubilidade, com
o intuito de identificar o grupo funcional das tais amostras e propor qual será o composto orgânico em cada
caso.
2. P art e Expe r i me nt al
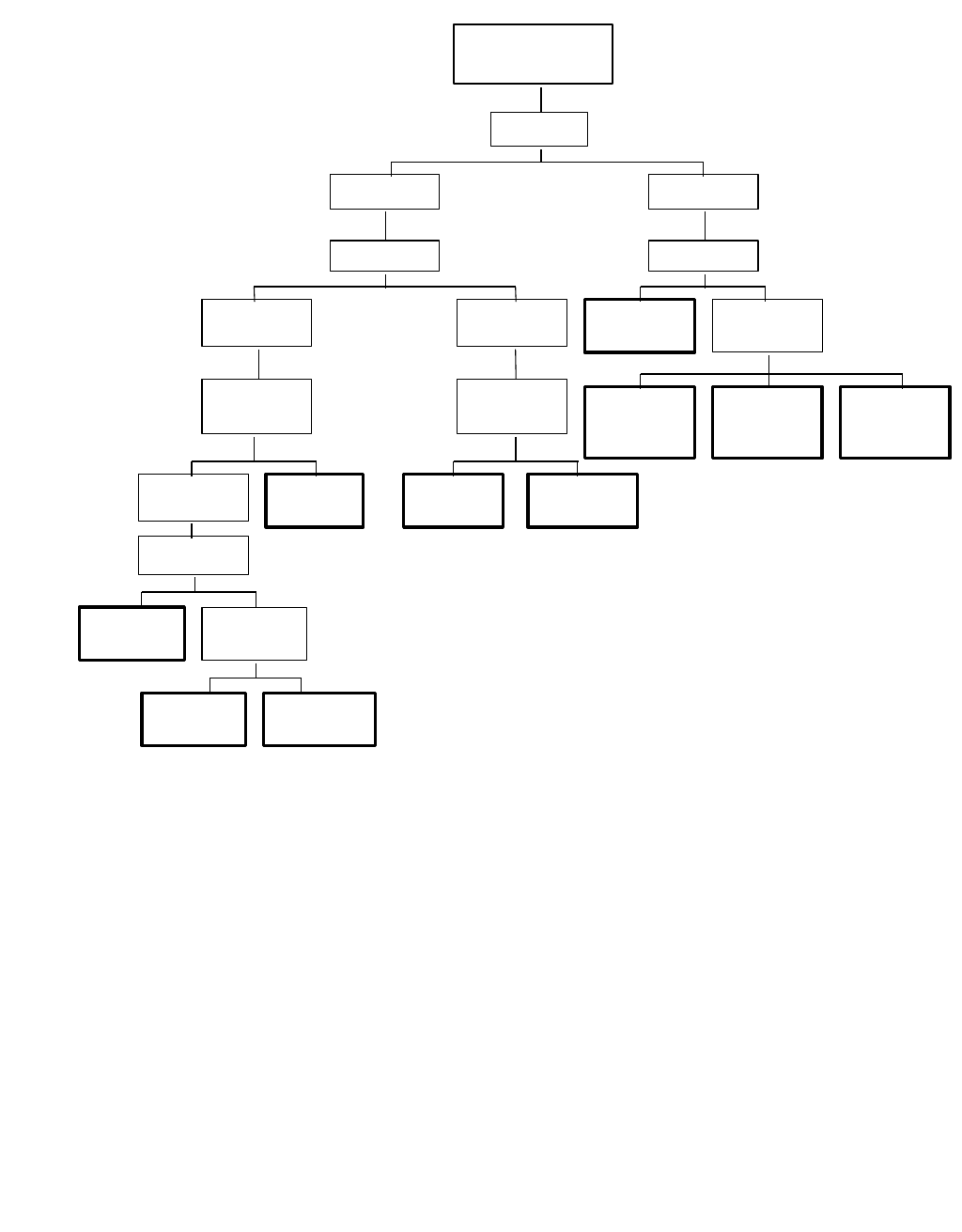
Havendo quatro tipos de amostra na bancada , foi utilizado um béquer para cada amostra do
sólido desconhecido, a seguir adic ionou- se também 3,0 ml do solvente. Então, foi agitado cuidadosamente
os béqueres e anotou- se os resultados. Foram usados os seguintes solventes: água, éter, H2SO 4,
N aHC O 3 5% , HC l 5% e N aO H 5% . Segue - se a Tabela1 indicando passo a passo da prática, em
seguida com o resultado obtido na Tabela 1 deve se observar o código obtido e analisar a Tabela2, para
avaliar e reconhecer a amostra desconhecida.
3
INSOL ÚVEL
I
SOL ÚVEL
N1
INSOL ÚVEL
N2
H3PO4 85%
H2SO4 96%
INSOL ÚVEL SOL ÚVEL
B
HCl 5%
INSOL ÚVEL
SOL ÚVEL
A1
INSOL ÚVEL
A2
NaHCO3 5%
SOL ÚVEL
NaOH 5%
INSOL ÚVEL
INSOL ÚVEL
S2
VER MELHO AO
TORNASSO L
SA
AZUL AO
TORNASSO L
SB
NÃO ALTE RA O
TORNASSO L
S1
SOL ÚVEL
ÉTER
SOL ÚVEL
ÁGUA
SUBSTÂNCIA
DESCONHECIDA
Tabe la 1 : clas s ificaç ão do s c o mpos to s o rg ânic o s pe la s o lubilidade .
3. Res ul t ado s e Di s c us são
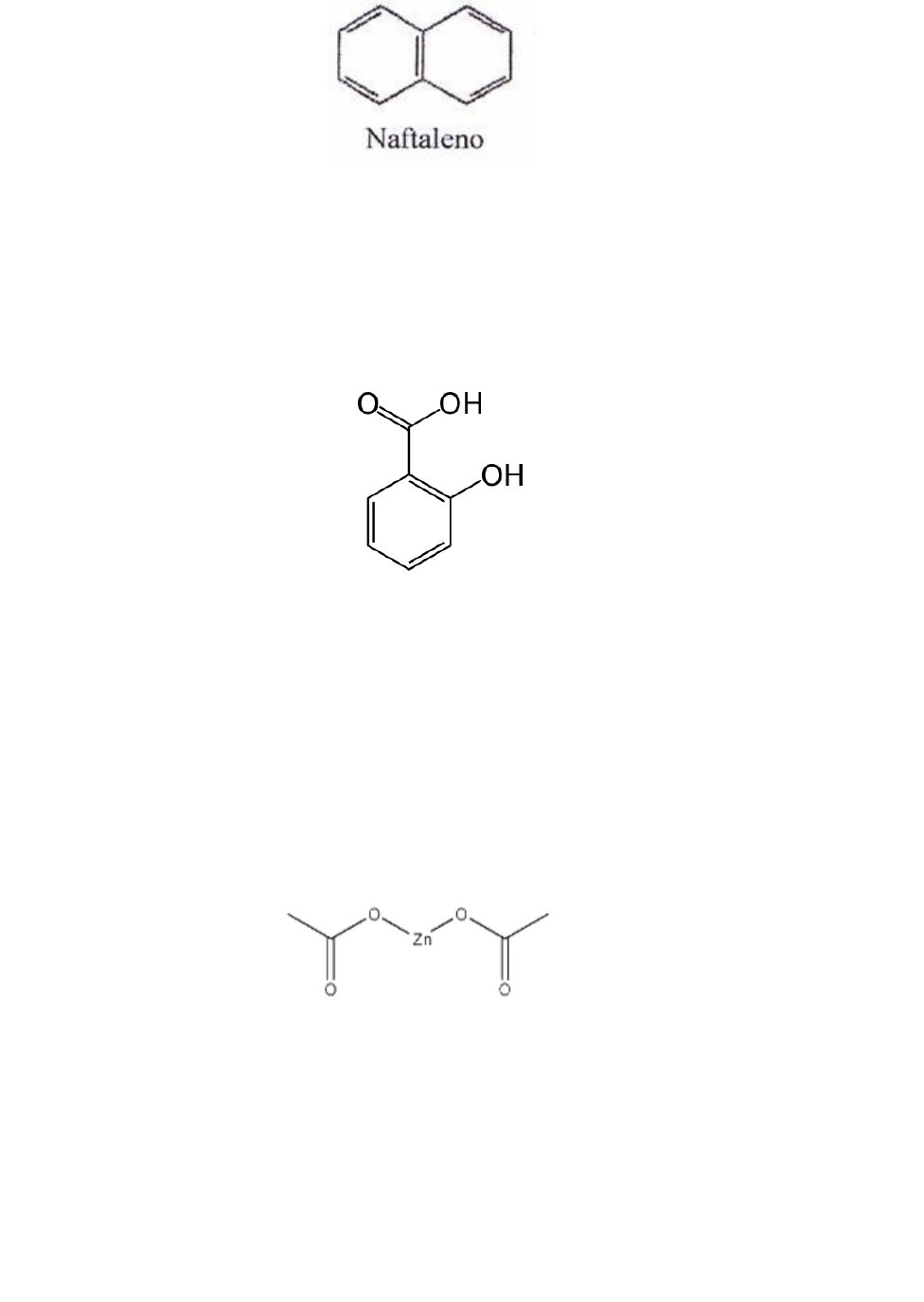
Amostra 1: N aftaleno
Em um tubo de ensaio colocamos uma pequena quantidade de naftaleno, cerca de 0,5g e
solubilizamos em água, e constatamos que não era solúvel. Em outro tubo de ensaio repetimos o
procedimento só que solubilizado em N AO H e verificamos o mesmo resultado. Após isso solubilizamos a
amostra em HC l com o mesmo resultado. Por último, realizamos com H2S O 4 96% e a amostra acabou
sendo insolúvel I.
4
Amostra 2: AAS
Em um tubo de ensaio colocamos uma pequena quantidade de AAS, em torno de 0,1g e
solubilizamos em água, sendo ela insolúvel, fazendo a mesma análise co m solvente N AO H temos o
resultado de solubilidade positivo, passamos a etapa seguinte que era solubilizar em N aHC O 3 5%
concluindo que era insolúvel, sendo classificado como A1 .
Amostra 3: Acetato de zinco
Em um tubo de ensaio colocamos 0,3g de acetato de zinco solubilizado em água, passamos a
próxima etapa solubilizando em N aO H 5% onde continuou sendo insolúvel, partindo para o HCL 5%,
verificamos a mesma coisa, continuamos com H2SO4 e depois H3P O 4 que por final constatamos ser
insolúvel N 2 . Durante o procedimento, observamos que o acetate de zinco se encaixava em outra classe de
solubilidade também, isso se deve as sua molécula, que em uma extremidade é polar e na outra apolar.
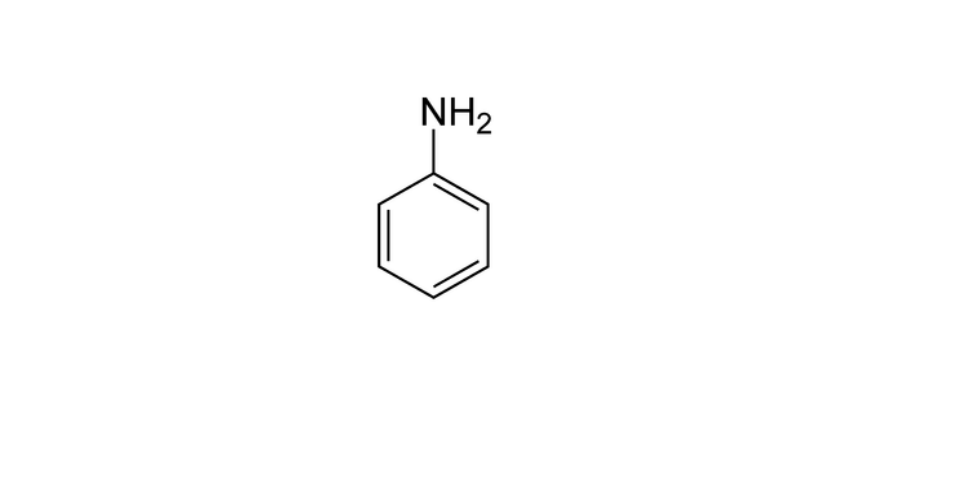
Amostra 4: Anilina
Em um tubo de ensaio colocamos 6 ml de Anilina onde não foi solubilizado em água, com N AOH
5
5% obtemos o mesmo resultado, passamos para a dissolução em HC L onde o composto foi dissolvido e
assim classificado como B.
4. Concl usão
Sendo assim conclui- se que os compostos analisados são compatíveis as classes pré - definidas nas
instruções passadas no roteiro.
5. Refe r ê nc i as
[1] VO GEL, A. I.; Quím ica Orgânica: análise orgânica qualitat iv a, 3ª ed.; Ao Livro
T écnico, Rio de janeiro, 1987.
[2] MARTIN S, C láudia R.; LO P ES, Wilson A.; AN DRADE, Jailson Bittencourt; Solubilidade das
subst âncias orgânicas, Universidade Federal da Bahia; Salvador/BA, julho, 2013.
[3] UTFP R, http://www.md.utfpr.edu.br/ /professores/form.php?id1=45069&idusuario=273
[4] INF O ESC O LA http://www.infoescola.com/quimica/eletronegatividade- e- eletropositividade/
Prévia do material em texto
�PAGE �4� SOLUBILIDADE DOS COMPOSTOS ORGÂNICOS VICTOR LOSSAVARO UTFPR – Universidade Tecnológica Federal do Paraná, Campus Medianeira, Engenharia de alimentos. Medianeira-PR, Brasil. Resumo Neste artigo demonstra-se a importância da solubilidade dos compostos, principalmente no dia a dia de um laboratório, pois a maioria das reações acontecem em uma solução, além de demonstrar os resultados obtidos. Nessa prática, é proposto que se determine a solubilidade de quatro compostos desconhecidos, através de alguns solventes, que são eles: água, éter, NaOH 5%, NaHCO3 5%, HCl 5%, H2SO4 95% e H3PO4 85%. Após os testes em cada um desses solventes, compara-se o resultado na tabela, para descobrir qual composto é. Para se determinar a solubilidade de cada mistura, formada por um soluto e um solvente, é necessário se atentar a teoria também, como a polaridade das ligações intermoleculares. A polaridade é um dos fatores determinantes para saber se uma mistura será homogênea ou heterogênea, assim como a eletronegatividade dos átomos de uma molécula, que segundo Linus Pauling, se a diferença entre elas for próxima ou igual a zero, determina uma ligação apolar. Palavras chaves: solubilidade; mistura; solvente; soluto; polaridade. * Autores correspondentes : victor_lossavaro@hotmail.com 1. introdução A solubilidade de uma substância é uma propriedade física muito importante qual se baseiam certos métodos de separação de misturas, de extração de produtos naturais e de recristalização de substâncias. Também é uma propriedade muito empregada nas indústrias de tintas, perfumes, sabão e detergente, açúcares e plásticos. Ela depende da natureza do soluto, do solvente e da temperatura. Para prever o comportamento de certos solutos em relação a certos solventes (à temperatura constante) é necessário se analisar as suas estruturas moleculares, ou melhor, o tipo de interação que há entre soluto e solvente. (VOGEL, 1983) O processo de solubilização de uma substância química resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente), e pode ser definida como a quantidade de soluto que dissolve em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo. É uma propriedade física (molecular) importante que desempenha um papel fundamental no comportamento das substâncias químicas, especialmente dos compostos orgânicos. (MARTINS, 2013) A solubilidade de uma substância orgânica está diretamente relacionada com a estrutura molecular, especialmente com a polaridade das ligações e da espécie química como um todo (momento de dipolo). Geralmente, os compostos apolares ou fracamente polares são solúveis em solventes apolares ou de baixa polaridade, enquanto que compostos de alta polaridade são solúveis em solventes também polares, o que está de acordo com a regra empírica de grande utilidade: “polar dissolve polar, apolar dissolve apolar” ou “o semelhante dissolve o semelhante”. Em alguns casos, a solubilidade de compostos orgânicos pode estar relacionada com a ocorrência de uma reação química. Assim, essa propriedade pode ser dividida em duas categorias: a solubilidade em que uma reação química é a força determinante (por exemplo, na reação ácido-base) e a solubilidade na qual estão envolvidas somente as forças intermoleculares. (MARTINS, 2013) A prática tem como objetivo identificar compostos orgânicos atráves de testes de solubilidade, com o intuito de identificar o grupo funcional das tais amostras e propor qual será o composto orgânico em cada caso. 2. parte experimental Havendo quatro tipos de amostra na bancada, foi utilizado um béquer para cada amostra do sólido desconhecido, a seguir adicionou-se também 3,0 ml do solvente. Então, foi agitado cuidadosamente os béqueres e anotou-se os resultados. Foram usados os seguintes solventes: água, éter, H2SO4, NaHCO3 5% , HCl 5% e NaOH 5% . Segue-se a Tabela1 indicando passo a passo da prática, em seguida com o resultado obtido na Tabela 1 deve se observar o código obtido e analisar a Tabela2, para avaliar e reconhecer a amostra desconhecida. Tabela 1: classificação dos compostos orgânicos pela solubilidade. 3. Resultados e Discussão Amostra 1: Naftaleno Em um tubo de ensaio colocamos uma pequena quantidade de naftaleno, cerca de 0,5g e solubilizamos em água, e constatamos que não era solúvel. Em outro tubo de ensaio repetimos o procedimento só que solubilizado em NAOH e verificamos o mesmo resultado. Após isso solubilizamos a amostra em HCl com o mesmo resultado. Por último, realizamos com H2SO4 96% e a amostra acabou sendo insolúvel I. Amostra 2: AAS Em um tubo de ensaio colocamos uma pequena quantidade de AAS, em torno de 0,1g e solubilizamos em água, sendo ela insolúvel, fazendo a mesma análise com solvente NAOH temos o resultado de solubilidade positivo, passamos a etapa seguinte que era solubilizar em NaHCO3 5% concluindo que era insolúvel, sendo classificado como A1. Amostra 3: Acetato de zinco Em um tubo de ensaio colocamos 0,3g de acetato de zinco solubilizado em água, passamos a próxima etapa solubilizando em NaOH 5% onde continuou sendo insolúvel, partindo para o HCL 5%, verificamos a mesma coisa, continuamos com H2SO4 e depois H3PO4 que por final constatamos ser insolúvel N2. Durante o procedimento, observamos que o acetate de zinco se encaixava em outra classe de solubilidade também, isso se deve as sua molécula, que em uma extremidade é polar e na outra apolar. Amostra 4: Anilina Em um tubo de ensaio colocamos 6 ml de Anilina onde não foi solubilizado em água, com NAOH 5% obtemos o mesmo resultado, passamos para a dissolução em HCL onde o composto foi dissolvido e assim classificado como B. 4. Conclusão Sendo assim conclui-se que os compostos analisados são compatíveis as classes pré-definidas nas instruções passadas no roteiro. 5. referências [1] VOGEL, A. I.; Química Orgânica: análise orgânica qualitativa, 3ª ed.; Ao Livro Técnico, Rio de janeiro, 1987. [2] MARTINS, Cláudia R.; LOPES, Wilson A.; ANDRADE, Jailson Bittencourt; Solubilidade das substâncias orgânicas, Universidade Federal da Bahia; Salvador/BA, julho, 2013. [3] UTFPR, http://www.md.utfpr.edu.br/ /professores/form.php?id1=45069&idusuario=273 [4] INFOESCOLA http://www.infoescola.com/quimica/eletronegatividade-e-eletropositividade/ _1353429396.ppt * * *









