
UNIVERSIDADE FEDERAL DE SANTA MARIA
CENTRO DE CIÊNCIAS NATURAIS E EXATAS CURSO:
ENGENHARIA QUÍMICA
NOME:Luana de Freitas Barros TURMA: 12
DATA DA AULA PRÁTICA: 21/06/2024
TÍTULO: POTENCIOMETRIA - EXPERIMENTO F
1 OBJETIVOS
! " #
$ % & %
" ' ( )
*+,$
2 MATERIAIS E MÉTODOS
2.1 MATERIAIS
- ( . $
/ .$ 0 % 123 40 12 40
53 40 ,$0
AgNO3
35352 640 $
$7
2.2 MÉTODOS
8 ) 53 4 ,$ % 12 34
)5334 .$ +) $$ %
) +)
AgNO3
3535264
4$) $ ) 32 4
7 % '
, 32 4 )
) ( &
%9) )1 $./5
:! (: 4!! 5

6 : ( :; 4!! - )
*+$<
3 RESULTADOS E DISCUSSÕES
)
)
* ( ) $
%
V E (mV) V E EV
V' (média entre os
acréscimos
0 36 0,5 0 0 0,25
0,5 36 0,5 0 0 0,75
1 36 0,5 1 2 1,25
1,5 37 0,5 3 6 1,75
2 40 0,5 1 2 2,25
2,5 41 0,5 1 2 2,75
3 42 0,5 3 6 3,25
3,5 45 0,5 2 4 3,75
4 47 0,5 2 4 4,25
4,5 49 0,5 2 4 4,75
5 51 0,5 3 6 5,25
5,5 54 0,5 3 6 5,75
6 57 0,5 3 6 6,25
6,5 60 0,5 3 6 6,75
7 63 0,5 4 8 7,25
7,5 67 0,5 5 10 7,75
8 72 0,5 7 14 8,25
8,5 79 0,5 8 16 8,75
9 87 0,5 15 30 9,25
9,5 102 0,5 28 56 9,75
10 130 0,5 147 294 10,25
10,5 277 0,5 28 56 10,75
11 305 0,5 15 30 11,25
11,5 320 0,5 9 18 11,75
12 329 0,5 6 12 12,25
12,5 335 0,5 5 10 12,75
13 340 0,5 4 8 13,25
13,5 344 0,5 4 8 13,75
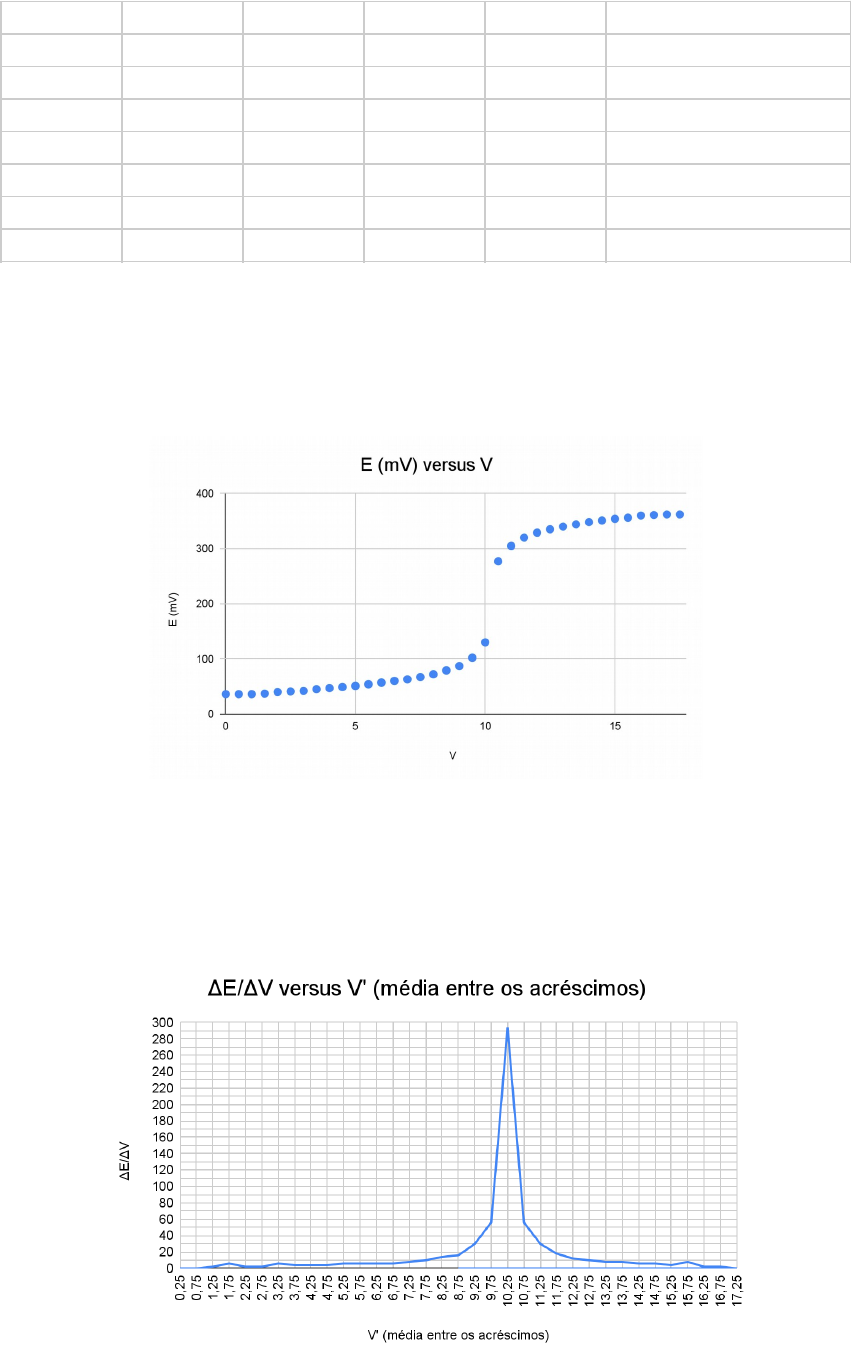
14 348 0,5 3 6 14,25
14,5 351 0,5 3 6 14,75
15 354 0,5 2 4 15,25
15,5 356 0,5 4 8 15,75
16 360 0,5 1 2 16,25
16,5 361 0,5 1 2 16,75
17 362 0,5 0 0 17,25
17,5 362 -17,5 0 0 8,75
95=>?
@ ) $. (
A.5=:!(:
+) $.
% )
(

A.1=B6B:(:C
$. ) %
5312 4 - *+ ,$ )
% % .
$ 35352 64 .
>
Ag+¿ ¿
D
Cl−¿ ¿
⇌ $+!
35352E53334
(E53124
(F33353G
Ag+¿ ¿
F33353G
Cl−¿ ¿
@ ) % $
% 5/5 , ) $$
*+ ) $
%'
5*+E2H2$
33353G*+EI
IF33J5$
33J5$*+E534
E5334
F3J5<
4 CONCLUSÃO
+ . . ) % (
# %
% ,$
) % *+ 3K< %
3J5< % % (
,%
" # % '
?111< % #
.
# % '
%
5 REFÊRENCIAS ok
LM44N4O/P##P(
QL131?
Q"4MRS" @ +4"N9" @ QT@8" 3K < *"L @" -N"@M9" Q"4MRS" U8Q8"4TA8+
+ , 3K< V/ W @# /
XY/66ZZZ$66)666))6
6%6JG1H'))5[/\/(F"<13<13<13<+?<]?
<133^/13'131G
9 V/ W @# / XY/66ZZZ1_6666
135J63H6)J)<+?<`<+?<?))<+?<`<+?<?^
Prévia do material em texto
UNIVERSIDADE FEDERAL DE SANTA MARIA CENTRO DE CIÊNCIAS NATURAIS E EXATAS CURSO: ENGENHARIA QUÍMICA NOME: Luana de Freitas Barros TURMA: 12 DATA DA AULA PRÁTICA: 21/06/2024 TÍTULO: POTENCIOMETRIA - EXPERIMENTO F 1 OBJETIVOS As técnicas potenciométricas envolvem a medição do potencial da célula, especificamente a diferença de potencial entre o eletrodo indicador e o eletrodo de referência. Esses eletrodos são submersos na solução do analito, onde nenhuma corrente flui (a intensidade da corrente é efetivamente zero). O método específico empregado neste caso é a volumetria de precipitação, que se baseia em reações que produzem compostos com solubilidade limitada. O objetivo do experimento é utilizar-se desse método para calcular a concentração de NaCl no soro fisiológico. 2 MATERIAIS E MÉTODOS 2.1 MATERIAIS Para a realização do experimento, é necessário a utilização dos seguintes materiais: água deionizada; béquer de 250 mL; bureta de 25 mL; pipeta volumétrica de 10 mL; soro fisiológico; solução padrão de 0,1015 mol/L; agitador magnético, eletrodo de prata combinado e potenciômetro. 2.2 MÉTODOS Inicialmente, pipeta-se 10 mL de soro fisiológico no béquer de 250mL e acrescenta-se 100 mL de água deionizada. Coloca-se o agitador magnético no béquer e conecta-se ao eletrodo de prata combinado. Coloca-se 0,1015 mol/L padrão na bureta. Liga-se o agitador e adiciona-se a partir da bureta 0,5 mL a cada vez, esperando estabilizar o potenciômetro para que haja a leitura da diferença de potencial da solução. Após anotar os resultados a cada 0,5 mL, detecta-se o salto potenciométrico e termina-se o experimento nas imediações do ponto de equivalência. Tabela-se os dados e plota-se 2 gráficos: 1 da diferença de potencial pelo volume (E (mV) x V (mL)) e 1 da variação de potencial dividido pela variação do volume pela média entre os acréscimos (E / V x V´ (mL)). Por fim, calcula-se a concentração de NaCl na amostra em g%. 3 RESULTADOS E DISCUSSÕES A partir dos volumes adicionados no sistema, pode-se descobrir o valor das diferenças de potencial da solução. Além disso, calculou-se a variação dos volumes, das diferenças de potencial, a razão entre eles e a média entre os volumes acrescidos. Na tabela abaixo tem-se os resultados obtidos e essa se seguiu até ser encontrado o ponto de equivalência. V E (mV) ΔV ΔE ΔE/ΔV V' (média entre os acréscimos 0 36 0,5 0 0 0,25 0,5 36 0,5 0 0 0,75 1 36 0,5 1 2 1,25 1,5 37 0,5 3 6 1,75 2 40 0,5 1 2 2,25 2,5 41 0,5 1 2 2,75 3 42 0,5 3 6 3,25 3,5 45 0,5 2 4 3,75 4 47 0,5 2 4 4,25 4,5 49 0,5 2 4 4,75 5 51 0,5 3 6 5,25 5,5 54 0,5 3 6 5,75 6 57 0,5 3 6 6,25 6,5 60 0,5 3 6 6,75 7 63 0,5 4 8 7,25 7,5 67 0,5 5 10 7,75 8 72 0,5 7 14 8,25 8,5 79 0,5 8 16 8,75 9 87 0,5 15 30 9,25 9,5 102 0,5 28 56 9,75 10 130 0,5 147 294 10,25 10,5 277 0,5 28 56 10,75 11 305 0,5 15 30 11,25 11,5 320 0,5 9 18 11,75 12 329 0,5 6 12 12,25 12,5 335 0,5 5 10 12,75 13 340 0,5 4 8 13,25 13,5 344 0,5 4 8 13,75 14 348 0,5 3 6 14,25 14,5 351 0,5 3 6 14,75 15 354 0,5 2 4 15,25 15,5 356 0,5 4 8 15,75 16 360 0,5 1 2 16,25 16,5 361 0,5 1 2 16,75 17 362 0,5 0 0 17,25 17,5 362 -17,5 0 0 8,75 Tabela 1 – Absorbâncias da solução 3 Dados os dados obtidos acima, plota-se um gráfico da diferença de potencial x volumes do titulante. Gráfico 1 – E (mV) x V Cria-se também um gráfico das médias dos volumes acrescidos pela diferença de potencial, a fim de descobrir em qual volume teve-se o salto potenciométrico do experimento. Gráfico 2 – ΔE/ΔV x V’ Analisando o gráfico acima, conclui-se que o salto potenciométrico ocorreu no volume 10,25 mL. Para encontrar a concentração de NaCl no soro fisiológico, deve-se fazer primeiramente a estequiometria da prata e do cloro, sendo que o cátodo de prata surge a partir do nitrato de prata 0,1015 mol/L, descobrindo a concentração do cátodo de prata e do ânodo de cloro. + ⇌ AgCl (s) 0,1015 mol — 1000 mL x — 10,25 mL x = 0,00104 mols de = 0,00104 mols de Diz-se que a concentração de mols é igual para os dois elementos por conta da estequiometria 1:1 da reação. Após, utiliza-se da mesma para calcular a gramagem do NaCl e por fim, calcula-se a porcentagem da molécula na amostra, encontrando o resultado que se objetivava encontrar. 1 mol NaCl — 58,5 g 0,00104 mols NaCl — y y = 0,061g 0,061g NaCl — 10 mL z — 100 mL z = 0,61 % 4 CONCLUSÃO Com base nas análises práticas, percebe-se que o experimento teve sucesso na parte de instrumentação, mas em relação aos dados, este não é possível de dizer que foi sucedido, dado que de acordo com a bula de uma solução fisiológica encontrada, tem-se que a concentração de NaCl na mesma é de 0,9%, sendo que o encontrado foi de 0,61%, o que nos mostra que em relação aos dados, o experimento não foi tão satisfatório quanto esperado. Os problemas possíveis de ser encontrados e que justificam parcialmente a diferença de resultado e um erro de 32,22% são de que tivemos possíveis erros na hora da prática, como limpeza dos instrumentos, erro no manuseio dos materiais e também é possível de dizer que talvez o medicamento, o soro, não esteja na concentração adequada. 5 REFÊRENCIAS ok MULLER, Aline Lima Hermes. Apostila: Química Analítica Quantitativa Experimental. Santa Maria. 2023 SOLUÇÃO DE CLORETO DE SÓDIO 0,9 % NOME DO PRODUTO SOLUÇÃO FISIOLÓGICA Cloreto de sódio 0,9%. [s.l: s.n.]. Disponível em: . Acesso em: 20 jun. 2024. Titulação de precipitação. [s.l: s.n.]. Disponível em: . image2.jpg image1.png image3.png


